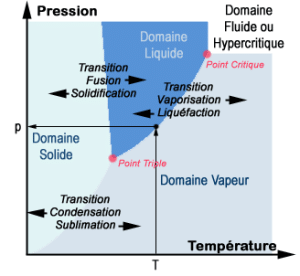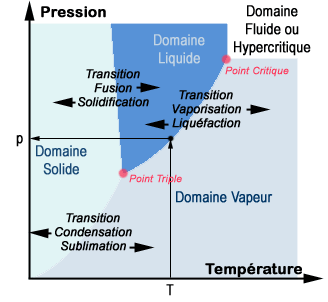
Diagramme de phase de l’eau

Solide ou liquide ? Une goutte de bitume met 9 ans à tomber!!! (pitch drop experiment, Queensland university) IgNobel 2005
Ch I : Introduction
- Les différents états de la matière
- Classification par type d’ordre et par type de liaison chimique
- Rappels de physique atomique et moléculaire.
Supports de cours
- Introduction et physique atomique et moléculaire
- Rappels de Mécanique quantique (notations de Dirac)
- Rappels sur la liaison carbone (sp,sp2,sp3)
- Potentiel central (cours Paolo Giannozzi)
- Méthode variationnelle (cours Paolo Giannozzi)
Énergie dans le sel
(cristaux ioniques)
Molécule H2+
- Structure des cristaux ioniques.
- Énergie des cristaux ioniques.
- Constante de Madelung et convergence.
- Énergie totale et paramètre d’équilibre.
- Compressibilité/rigidité.
- Ordres de grandeur.
- Le Hamiltonien .
- Combinaison linéaire d’orbitales atomiques.
- Équation de Schrödinger.
- Intégrale de saut, dérive etc..
- Diagonalisation du Hamiltonien
- Énergie totale