La possibilité d’utiliser la chaleur issue de processus industriels comme source d’énergie d’appoint en complément de l’énergie d’origine fossile est une alternative de plus en plus envisagée. La récupération de cette énergie thermique peut être obtenue par voie thermoélectrique (effet Seebeck). Ainsi, quand on applique un gradient de température ΔT à un solide conducteur, les électrons en contact avec la partie chaude acquièrent une énergie cinétique et diffusent vers la région froide, ce qui crée un champ électrique E=-∇V = Se ∇T. Le coefficient Se est le coefficient Seebeck et caractérise la conversion de la chaleur en énergie électrique. Plus précisément, le rendement de la conversion, défini comme le rapport entre la puissance électrique obtenue et la puissance thermique injectée dans le système, est une fraction η =ηC .f(ZT), du rendement de Carnot ηC , où f(ZT) est une fonction monotone croissante du paramètre adimensionnel ZT, appelé « facteur de mérite »:
ZT = T Se2 (σ/k)
où σ est la conductivité électrique du matériau, k sa conductivité thermique et T la température moyenne.
Le rendement de conversion thermoélectrique h rejoint le rendement de Carnot hC quand le facteur de mérite ZT tend vers l’infini. La recherche de matériaux adaptés pour la conversion thermoélectrique est donc vouée à l’étude de matériaux présentant des facteurs de mérite élevés. Actuellement, certains semi-conducteurs à faible gap et fortement dopés donnent des facteurs de mérite de l’ordre de 1. Un facteur de mérite de 3 donnerait un rendement acceptable de 0.33 ηC . La recherche de facteurs de mérite plus élevés s’oriente de plus en plus vers des matériaux nanostructurés pour lesquels de faibles valeurs de la conductivité thermique ont été obtenues tout en conservant des valeurs élevées de la conductivité électrique (voir l’équation ci-dessus). Les matériaux nanostructurés bien que possédant des propriétés intéressantes présentent toutefois des coûts de fabrication élevés et ne sont utilisés aujourd’hui qu’au stade du laboratoire.
Une autre voie de recherche qui consiste à utiliser les électrolytes comme porteurs de charge à la place des électrons ou des trous dans les matériaux solides est encore peu explorée. Le coefficient Seebeck étant directement relié à l’entropie transportée par les ions, on s’attend à des valeurs élevées de Se dans des électrolytes contenant des macro-ions. Les systèmes thermiques pour la conversion thermoélectrique basée sur les électrolytes sont appelés cellules thermogalvaniques.
En 2011, nous avons mesuré des valeurs élevées du coefficient Seebeck, de l’ordre de 7 mV/K dans des électrolytes contenants de gros ions tetra-alkylammoium en solution dans des alcanes [1] à comparer aux matériaux solides qui ont un coefficient Seebeck de quelques centaines de mV/K. Malheureusement, ces mélanges ioniques présentent de faibles valeurs de la conductivité électrique ionique ce qui pénalise fortement le facteur de mérite. L’utilisation des liquides ioniques purs ou en solution permet d’obtenir des valeurs élevées de la conductivité électrique proche de celle mesurée dans les solides conducteurs.
L’obtention d’un courant électrique à partir d’une cellule thermoélectrique peut s’obtenir via une réaction d’oxydo-réduction aux électrodes. Abraham et al. [2] ont mesuré récemment le pouvoir thermoélectrique dans différents liquides ioniques avec le couple redox I–/I3–. Ils ont montré que le liquide ionique pouvait avoir une influence sur le changement d’entropie de la réaction redox.
Nous avons étudié en détail les propriétés thermoélectriques du liquide ionique 1-ethyl-3-methylimidazolium tetrafluoroborate (EMIM+BF4–) en solution dans de l’acétonitrile (AN) en fonction de la concentration du liquide ionique CIL. Ce mélange binaire ionique possède une conductivité électrique parmi les plus élevées de l’ordre de 70 mS cm-1 à une concentration CIL=2.5 M. Afin d’obtenir un transfert réversible d’électrons aux électrodes de platine ou de carbone vitreux le couple redox organique thiolate/disulfide (McMT–/BMT) a été ajouté au mélange binaire ionique. Ce couple redox a été aussi proposé comme une alternative au couple I–/I3– utilisé dans les cellules solaires à colorants.
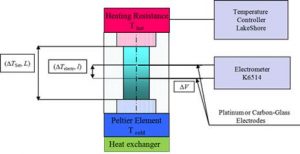
Le montage expérimental que nous avons utilisé pour mesurer l’effet thermoélectrique est montré dans la Figure 1.
Fig.1. Cellule thermoélectrique. L’échantillon liquide est contenu dans une cellule en Téflon de 14 mm de hauteur et de 14 mm de diamètre. Les deux extrémités sont fermées par deux hublots en saphir. La cellule est placée verticalement et chauffée par le haut au moyen d’un film résistif collé. La fenêtre du bas est maintenue à température constante. Deux électrodes de platine ou de carbone vitreux sont insérées dans de fins tubes en verre qui sont séparés de 6 mm le long de l’axe de la cellule. Le gradient de température le long de l’axe de la cellule est stable. La différence de potentiel entre les deux électrodes est mesurée à circuit ouvert au moyen d’un électromètre à haute impédance.
Le couple redox McMT-/BMT dissout dans le mélange binaire ionique possède une réversibilité ainsi qu’une stabilité remarquables comme cela est montré en Fig. 2.
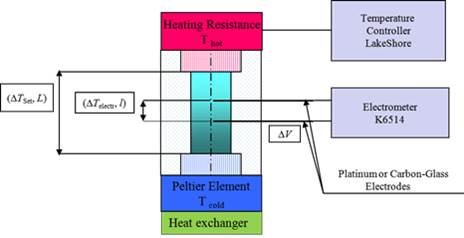
Fig.2. Différence de potentiel mesurée à circuit ouvert entre deux électrodes de platine dans un mélange 4M EMIMBF4 +6mM TBA-McMT + 6mM BMT dans AN (tracé inférieur, en bleu) en fonction de la température de la fenêtre supérieure de la cellule (tracé du haut, en noir). La température de la fenêtre du bas est maintenue à 30°C pendant toute la durée de la mesure, excepté entre t=180h et 220h, où celle-ci suit la température du haut.
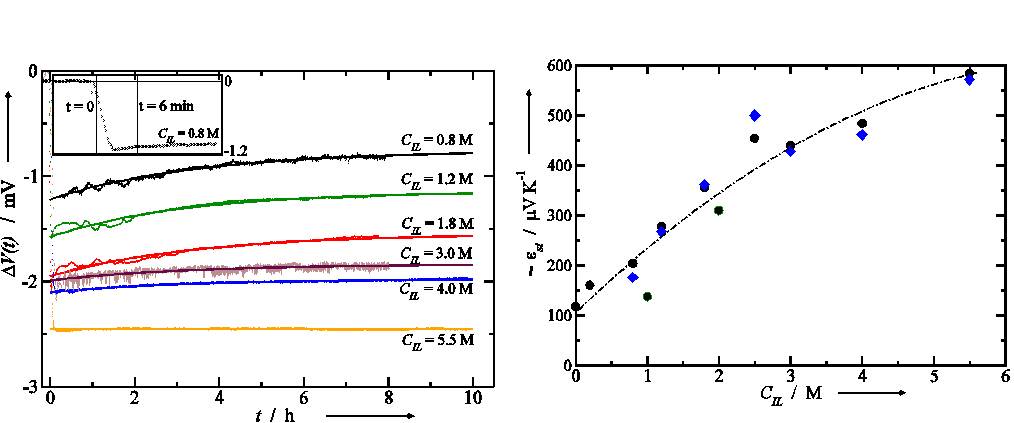
Des cycles en température entre 30°C et 60°C ont montré une excellente reproductibilité de la valeur du coefficient thermoélectrique sur une durée de vingt jours. Ces mesures effectuées sur des temps longs nous ont permis de distinguer deux contributions à l’effet thermoélectrique. D’une part, nous observons une variation rapide de la différence de potentiel suite à une variation de température des électrodes. Ceci est dû à la différence d’entropie de réaction qui a lieu aux électrodes. D’autre part, nous observons sur des temps très longs, la diffusion des ions due au gradient thermique, ce qui se traduit par une variation de la différence de potentiel selon une loi exponentielle. La valeur de l’effet thermoélectique εs augmente d’un facteur 6 quand la concentration du liquide ionique est CIL = 5.5M (Fig.3, droite).
Bien que le pouvoir thermoélectrique de l’ordre de 600 mV/K soit inférieur par rapport à celui mesuré dans un électrolyte aqueux avec un couple redox ferro/ferricyanide, ces résultats ont montré que l’on pouvait jouer à la fois sur la concentration du liquide ionique et sur celle du couple redox afin d’optimiser les propriétés thermoélectriques de liquides ioniques.
Fig.3. (Gauche) Variation au cours du temps de la différence de potentiel mesurée à circuit ouvert entre deux électrodes après avoir imposé un saut de température de 10K. La concentration de TBA+McMT- et BMT est Credox=10mM. Les différentes courbes sont obtenues pour différentes concentration CIL du liquides ionique. En insert, on montre un agrandissement de la variation de la différence de potentiel tout de suite après un saut de température. (Droite) Variation de l'effet thermoélectrique (εs) en régime stationnaire en fonction de la concentration du liquide ionique CIL. La concentration du couple redox est Credox=10mM.
[1] M. Bonetti, S. Nakamae, M. Roger, P. Guenoun, J. Chem Phys v134, 114513 (2011)
[2] T. J. Abraham, D. R. MacFarlane, J. M. Pringle, Chem Comm v.47, 6260 (2011)