L’un des composants les plus importants des batteries Li-ion est l’électrolyte, composé d’un sel dissous dans des solvants organiques. Ces solvants sont cependant souvent toxiques, nocifs pour l’environnement et inflammables. Pour pallier ce problème, on cherche à développer des batteries aqueuses, mais la faible stabilité électrochimique de l’eau (1,23 V en théorie) limite la tension de la batterie. Pour augmenter la fenêtre de stabilité jusqu’à 3 V, des électrolytes aqueux hautement concentrés, appelés water-in-salt (WISE), ont été proposés, pour lesquels la modification de l’environnement autour des molécules d’eau limite les réactions d’évolution du dioxygène (OER), et d’évolution du dihydrogène (HER). Cette dernière représente l’un des plus grands défis pour les batteries aqueuses, puisque la production de dihydrogène à partir de la réaction de réduction de l’eau entraîne une perte de capacité et d’efficacité des batteries. De plus les sels de lithium utilisés en grande quantité dans ces électrolytes sont couteux et souvent toxiques. Passer à des ions divalents tels que le magnésium pourrait permettre la fabrication d’électrolytes plus rentables et plus verts.
Des chercheuses des équipes LEEL et LIONS du NIMBE ont examiné la stabilité de ce type d’électrolyte dans des cellules complètes de batteries au magnésium. Pour évaluer leur stabilité, la production de dihydrogène venant de la réaction indésirable de réduction de l’eau dans différents types d’électrolytes aqueux au magnésium a plus particulièrement été étudiée [1]. Contrairement à ce qui est souvent rapporté dans la littérature, la production de cet H2 indésirable dépend principalement de la proportion de sel (ou d’eau) présente dans la solution, et non de la nature chimique de l’électrolyte. Ce résultat constitue un repère essentiel pour orienter la conception d’électrolytes aqueux plus stables et performants.
L’un des composants les plus importants des batteries Li-ion est l’électrolyte, qui consiste en un sel dissous dans des solvants organiques non aqueux. La grande quantité de solvant dans la solution constitue un véritable obstacle, les solvants utilisés étant toxiques, nocifs pour l’environnement et inflammables. Une solution plus durable consiste donc à remplacer ces solvants par de l’eau. Cependant, la fenêtre de stabilité thermodynamique de l’eau (1,23 V), étroite, limite son utilisation. Les chercheuses dans cette étude ont donc développé des électrolytes aqueux hautement concentrés appelés water-in-salt (WISE), ce qui a permis d’augmenter la valeur de cette fenêtre jusqu’à 3 V [2]. L’intérêt de cette nouvelle approche réside dans la modification de l’environnement des molécules d’eau en solution et la formation d’une interface protectrice sur l’électrode, qui limite la réaction d’évolution du dioxygène (OER), ainsi que la réaction de réduction de l’eau (réaction d’évolution du dihydrogène, HER). Cette dernière représente l’un des plus grands défis pour les batteries aqueuses et fait l’objet de nombreuses recherches et de débats.
La durabilité des ressources en lithium constitue également un défi majeur, en particulier dans le cas des WISE qui nécessitent une grande quantité de sel. Le passage à des ions divalents tels que le magnésium pourrait ainsi permettre la fabrication d’électrolytes concentrés plus rentables et plus respectueux de l’environnement. Cependant, les fenêtres de stabilité des électrolytes aqueux au magnésium sont inférieures à celles des solutions aqueuses de lithium, ce qui pourrait provenir de la solubilité limitée des sels de magnésium dans l’eau. Pour surmonter cette limitation, plusieurs stratégies visent à réduire la réactivité de l’eau, notamment en ajoutant un agent d’encombrement moléculaire, tel que le polyéthylène glycol (PEG). Une autre approche consiste à introduire un co-sel, donnant naissance aux électrolytes dits water-in-bisalt (WIBS), qui limitent la disponibilité des molécules d’eau. L’objectif de ces stratégies est de perturber fortement l’organisation des molécules d’eau en solution pour réduire son activité. Les anions dits cosmotropes favorisent le réseau de liaisons hydrogène de l’eau. À l’inverse, les anions chaotropes rompent ce réseau. Ils sont donc plus efficaces pour perturber les molécules d’eau en solution et peuvent théoriquement davantage limiter la réaction d’évolution du dihydrogène (HER). Cependant, bien que ces stratégies aient un impact significatif sur la structuration des molécules d’eau en solution, leur importance pour la réactivité à long terme des batteries aqueuses n’avait pas encore été démontrée à ce jour.
Dans cette étude [1], les chercheuses ont mis en évidence que bien que la nature de l’électrolyte ait une forte influence sur le réseau de liaisons hydrogène et les interaction ion-eau en solution, la production de H2, et par extension la stabilité des solutions, est principalement déterminée par la teneur en eau des solutions concentrées.
Pour comprendre la réactivité dans les batteries au magnésium à base d’électrolytes aqueux, et en particulier le rôle de la nature de l’électrolyte, les chercheuses ont comparé la structuration de l’électrolyte par spectroscopie infrarouge ainsi que la production de dihydrogène en étudiant divers électrolytes de magnésium contenant des quantités variables d’anions présentant des caractéristiques cosmotropiques ou chaotropiques différentes. Pour cela, ils ont notamment utilisé la spectroscopie infrarouge. En effet, la bande d’élongation O-H de l’eau fournit des informations précieuses sur la structuration de ces électrolytes, en particulier en ce qui concerne le réseau de liaisons hydrogène et les interactions eau-sel. Un décalage vers les hauts nombres d’onde de cette bande dénote des liaisons hydrogène plus faibles dans l’eau et une perturbation accrue du réseau de liaisons hydrogène par les ions environnants. Elles ont montré que les solutions à base d’acétate présentent, quelle que soit la concentration, une forme de la bande d’élongation O-H comparable à celle de l’eau pure. Ce comportement traduit la persistance d’un réseau de liaisons hydrogène fortement structuré, stabilisé par cet anion cosmotrope. En revanche, pour les sels chaotropes tels que Mg(TFSI)2 et Mg(ClO4)2, lorsque la molalité augmente, la bande d’élongation O-H est décalée vers les nombres d’onde plus élevés, traduisant l’affaiblissement global du réseau de liaisons hydrogène. De nombreuses interactions eau-eau sont remplacées par des interactions eau-anion et eau-cation lorsque la molalité augmente. Ainsi, les molécules d’eau sont occupées par la solvatation des ions, ce qui devrait limiter leur réactivité.
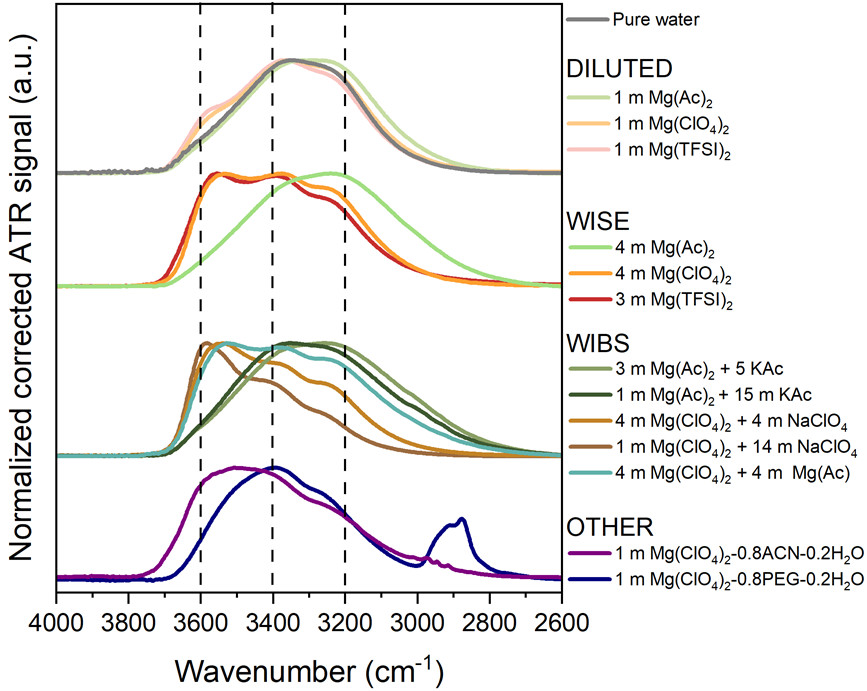
Bandes d’élongation O-H obtenus par spectroscopie infrarouge. Les différents électrolytes étudiés sont à base de sels d’acétate, de perchlorate et d’imide de magnésium à faible et forte concentration. De plus, des électrolytes WIBS (water-in-bisalt) à cations mixtes ont été examinés (acétate de magnésium avec acétate de potassium ou perchlorate de magnésium avec perchlorate de sodium). Un mélange de sels d’acétate de magnésium et de perchlorate (Mg(CH3COO)2 et Mg(ClO4)2, noté 4Mg4Mg), un WIBS à anions mixtes, a également été étudié. Finalement, l’ajout de PEG et d’acétonitrile (ACN) dans des solutions de perchlorate de magnésium ont aussi été évaluées.
Pour aller au-delà de l’influence de la nature de l’électrolyte sur la structuration de la solution, les chercheuses ont également analysé l’influence du type d’électrolyte sur la production de dihydrogène (H2) résultant de la réduction de l’eau. Pour ce faire, des batteries complètes ont été assemblées en utilisant les différentes solutions comme électrolytes dans des cellules adaptées aux mesures de gaz (voir figure ci-dessous, à gauche). La quantité de gaz a été déterminée par microchromatographie en phase gazeuse après 10 cycles de charge-décharge.
Clairement, l’anion semble avoir un impact minime sur la production d’H2, contrairement à la teneur en sel (ou en eau). Comme l’illustre la figure ci-dessous, la production d’H2 présente une dépendance identique à la fraction massique de sel, quelle que soit la nature de l’anion, ce qui indique que la teneur globale en sel (ou en eau) – plutôt que la simple présence de molécules d’eau libres observables par spectroscopie IR- régit principalement l’évolution de H2.
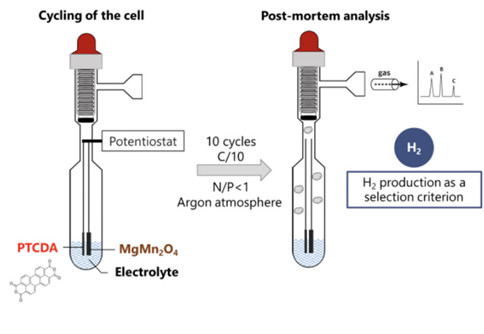
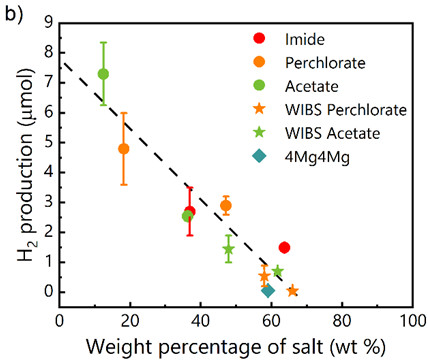
(gauche) Schéma de l’ampoule modifiée conçue pour coupler les mesures électrochimiques et la quantification de gaz et de la méthodologie utilisée dans l’étude. (droite) Production de dihydrogène après 10 cycles de charge-décharge en fonction du pourcentage de sel dans différentes solutions aqueuses.
En résumé, la production d’H2 décroit lorsque la concentration en sel augmente (voir schéma ci-dessous) mais est principalement déterminée par la teneur en eau des solutions concentrées. Contrairement aux hypothèses largement développées dans la littérature, ce résultat montre que la structure de l’électrolyte a peu d’effet sur la réactivité des batteries aqueuses concentrées. Des études comparatives sur d’autres systèmes, qu’ils soient monovalents ou multivalents (Li, Na, Zn), permettraient de vérifier le caractère universel de ce résultat. Une telle approche serait précieuse pour orienter la conception de batteries aqueuses concentrées plus performantes et durables.
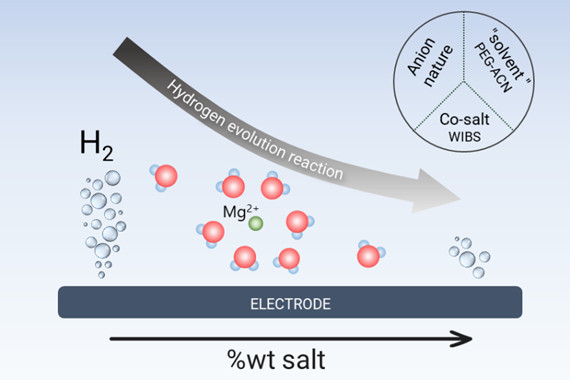
Schéma illustrant la corrélation directe entre la quantité de sel (ou d’eau) et la production indésirable d’hydrogène dans les électrolytes aqueux au magnésium, quelle que soit la nature de l’électrolyte considéré.
Références
[1] Is the Amount of Water the Most Important Parameter in Concentrated Aqueous Electrolytes? The Case of Aqueous Magnesium Cells, Malaurie Paillot, Sophie Le Caër, and Magali Gauthier, ACS Electrochemistry, 2025 1 (8), 1452-1461.
[2] « Water-in-salt” electrolyte enables high-voltage aqueous lithium-ion chemistries, Liumin Suo, Oleg Borodin, Tao Gao, Marco Olguin, Janet Ho, Xiulin Fan, Chao Luo, Chunsheng Wang, Kang Xu, Science 2015, 2015 350 (6263), 938.
Contacts CEA
- Magali Gauthier, NIMBE – Nanosciences et Innovation pour les Matériaux, la Biomédecine et l’Énergie, LEEL – Laboratoire d’Etude des Eléments Légers, CEA-IRAMIS.
- Sophie LE CAER, NIMBE – Nanosciences et Innovation pour les Matériaux, la Biomédecine et l’Énergie, LIONS – Laboratoire Interdisciplinaire sur l’Organisation Nanométrique et Supra Moléculaire, CEA-IRAMIS.