Du fait même de sa structure moléculaire, l’eau présente un très grand nombre d’anomalies physico-chimiques par rapport à un liquide ordinaire avec un diagramme de phases complexe. On peut par exemple mettre le liquide en surfusion jusqu’à 235 K (-38°c) à pression atmosphérique, mais sa cristallisation reste inévitable, entrainant une expansion du volume à l’origine de multiples problèmes.
Par l’ajout de glycérol, il est possible de préserver l’état liquide à des températures bien plus basses et d’en observer les propriétés structurales en ralentissant considérablement la cinétique de cristallisation. Au-delà de l’intérêt fondamental sur la compréhension de la dynamique de l’eau surfondue, ce type d’étude présente un grand intérêt pour les applications en cryo-préservation biologique et contribuer à en définir les meilleures conditions thermodynamiques de mise en œuvre.
Les expériences réalisées, notamment par diffusion de neutrons polarisés avec la possibilité de distinguer les diverses contributions moléculaires, montrent que même au sein la phase vitreuse d’une solution eau-glycérol, l’eau pure finit par cristalliser. La description approfondie des phases obtenues permet ensuite d’infirmer un modèle théorique largement cité de l’eau, proposant l’existence d’une nouvelle phase à basse température, composée de 2 liquides de densité différente, associée à un nouveau point critique.
Tout autour de nous, il n’est pas rare de trouver l’eau dans son état surfondu, maintenue à l’état liquide malgré des températures inférieures à 0°C (273.16K). Étudier les propriétés de l’eau dans ces conditions est difficile, le liquide ayant une forte propension à cristalliser à la moindre sollicitation externe. Cette forte tendance à la cristallisation est aussi une forte limitation pratique à la cryoconservation de systèmes biologiques et la conservation de cellules ou d’organes de façon viable à ultra-basse température. C’est aussi une difficulté expérimentale majeure pour comprendre le comportement insolite de l’eau dans cet état surfondu et sa cristallisation, avec des conséquences importantes dans un très grand nombre de domaines : biologie, géologie et environnement…
Pour pallier cette difficulté, l’addition d’autres composés, tel qu’un sel, un sucre ou un alcool, est souvent proposée afin de retarder, voire supprimer, la cristallisation à très basse température. Ainsi l’ajout d’une certaine quantité de glycérol est un des stratagèmes expérimentaux pour étudier les propriétés de l’eau liquide dans un domaine expérimentalement inaccessible, i.e. en dessous du point de fusion Tm (0°c ou 273.16 K pour l’eau pure), jusqu’à sa transition vitreuse Tg (-137°c ou 136K) à pression atmosphérique (l’état vitreux ne pouvant être atteint qu’après une hypertrempe, par exemple). En suivant des propositions théoriques, les chercheurs du LLB et leurs collègues se sont intéressés dans cette étude à répondre aux questions suivantes :
- Est-il possible d’observer la coexistence de deux phases liquides, une de haute densité, l’autre de basse densité (LDL pour Low Density Liquid et HDL pour High Density Liquid),
- Comme suggéré par des simulations numériques, existe-t-il un 2ème point critique dans l’eau, terminant la ligne critique séparant les deux phases liquides LDL et HDL ?
la réponse à ces questions étant un élément important pour parvenir à correctement expliquer le comportement « anormal » de l’eau (1).
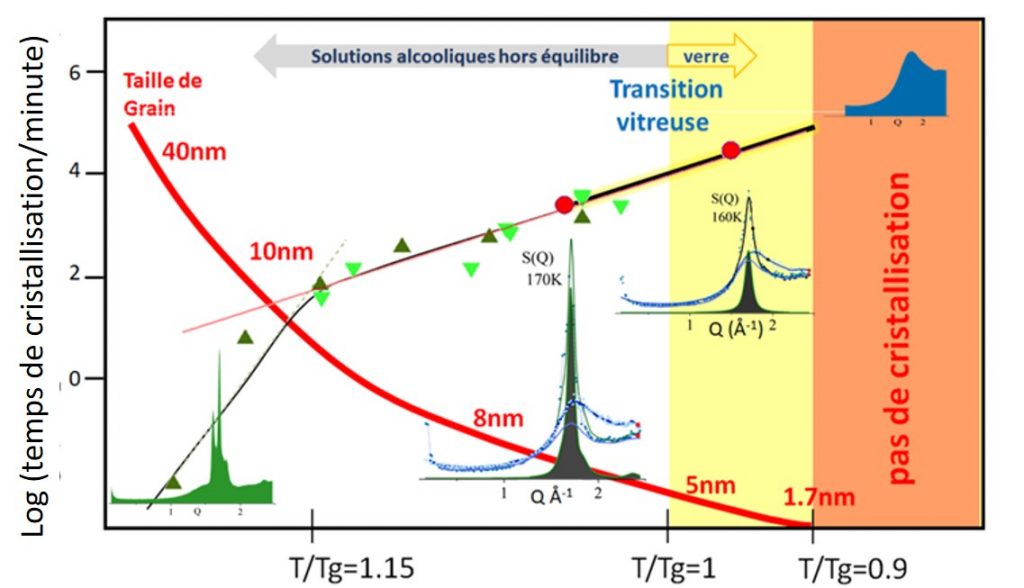
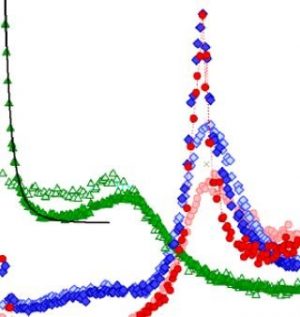
Cinétique de cristallisation en fonction de la température (coordonnée réduite T/Tg) : pour la solution eau-glycérol (●) et l’eau pure (données de la littérature) obtenue par hyperquench de gouttelettes à 106 ou 107 K/s (▲ [6])), ou par décompression rapide à basse température (▼ [7]) . Les spectres de diffraction de neutrons sont donnés à différentes températures.
L’évolution en température de la taille des grains de glace est donnée par la ligne rouge. La température limite en dessous de laquelle la cristallisation de l’eau ne se produit pas dans les solutions aqueuses est de l’ordre de 0.9 Tg.
Par diffusion de neutrons polarisés, l’équipe rassemblée autour des chercheurs du LLB, a sondé la structure de solutions eau-glycérol (à l’aide du diffractomètre D7 à l’ILL, puis G44 sans analyse de polarisation au LLB), pour différents traitements thermiques testés au préalable par calorimétrie. Afin de séparer les contributions des molécules impliquant le réseau de liaisons hydrogène, l’expérience a été réalisée en profitant des possibles substitutions isotopiques de l’hydrogène par le deutérium. La cinétique de cristallisation de l’eau à différentes températures a alors été déterminée avec ses paramètres clés, tels que la taille, la forme et la nature des cristallites de glace, la fraction de l’eau convertie en glace ou celle résiduelle à l’état amorphe, et le temps de cristallisation (nucléation et croissance) en fonction de la température de recuit.
Il est ainsi montré que, même en-dessous de la transition vitreuse Tg, d’une solution eau-glycérol de fraction molaire 0.18, la cristallisation de l’eau pure reste possible sur une échelle de temps de l’ordre de 10 h, ce délai devant atteindre, par extrapolation des données, 4 jours pour une température dix degrés en dessous de Tg, avec une taille de cristallites de l’ordre de 1.7 ± 0,1 nm à -123°c (150 K) (ligne rouge sur la figure).
Cette description structurale du système s’est poursuivie avec l’étude de ses propriétés dynamiques par diffusion quasiélastique de neutrons par écho de spin sur l’instrument MUSES du LLB, complétée par des mesures du coefficient de diffusion par RMN et des données de spectroscopie diélectrique [4,5]. L’ensemble des données permet d’infirmer la proposition faite par Tanaka [4] de l’existence d’une transition liquide-liquide « isocompositionnelle » de la solution eau-glycérol, consécutive à une transition liquide-liquide sous-jacente de l’eau. Ces résultats soulignent le caractère hors d’équilibre thermodynamique des phases observées dans une large gamme de température et l’importance des conditions du traitement thermique appliqué au système.
Il est ensuite montré qu’en utilisant la variable réduite T/Tg, il devient possible de comparer les cinétiques de cristallisation de différentes solutions aqueuses avec celle de l’eau pure, et d’observer que ces divers systèmes suivent une même loi d’échelle. Cette règle empirique permet alors d’estimer la plus basse température à laquelle la cristallisation de l’eau pure peut se produire, qui est de l’ordre de -149°c (124 K). Cette valeur est remarquablement en accord avec les résultats de la littérature [3] (expériences et simulations), qui montrent que les germes, nécessaires pour initier la formation de la glace « cubique », doivent contenir au moins 90 molécules à 150K, ce qui correspond à une taille d’environ 1.6 nm à 1.7 nm.
Cette connaissance de la loi régissant la taille, la nature (cubique et/ou hexagonale), la forme des cristallites et la fraction de glace formée doit contribuer à mieux concevoir des mélanges cryo-protecteurs. L’impossibilité observée d’éviter toute cristallisation des solutions eau-glycérol, pour les concentrations et les traitements thermiques appliqués lors du refroidissement puis du réchauffement, indique que l’ajout d’autres produits (polymères par exemple) inhibiteurs de recristallisation de la glace seront nécessaires.
Références :
- [1] « Water anomalies », Martin Chaplin.
- [2] » Interplay of vitrification and ice formation in a cryoprotectant aqueous solution at low temperature »
- C. Alba-Simionesco , P. Judeinstein, S. Longeville, O. Osta , F. Porcher, F. Caupin, G. Tarjus, I. Proc. Natl. Acad. Sci. 119(12) (2022) e2112248119
- [3] « The end of ice I »
D.R. Moberg, D. Becker, C. W. Dierking, F. Zurheide, B. Bandow, U. Buck, A. Hudait, V. Molinero, F. Paesani and T. Zeuch, I. Proc. Natl. Acad. Sci. U.S.A. 116 (2019) 24413–24419 - [4] « Liquid–liquid transition without macroscopic phase separation in a water–glycerol mixture »
K. Murata et H. Tanaka, Nature Materials 11,(5) (20??) 436‑443 - [5] « The puzzling first-order phase transition in water–glycerol mixtures »
I. Popov, et al, Physical Chemistry Chemical Physics, 17(27) (2015) 18063‑18071 - [6] Kinetics of crystallizing D2O water near 150 K by Fourier transform infrared spectroscopy and a comparison with the corresponding calorimetric studies on H2O water
W. Hage, A. Hallbrucker, E.Mayer, G. P. Johari J. Chem. Phys. 103 (1995) 545–550 - [7] Experimental evidence of low-density liquid water upon rapid decompression
C. Lin, J. S. Smith, S. V. Sinogeikin, G. Shen, Proc. Natl. Acad. Sci. U.S.A. 115 (2018) 2010–2015
Voir l’actualité de la Fédération Française de Diffusion Neutronique – 2FDN.
Contacts :
- Christiane Alba-Simionesco , Patrick Judeinstein, Stéphane Longeville, Oriana Osta , Florence Porcher, Lab. Léon Brillouin – CEA/Saclay (France)
- Frédéric Caupin, Institut Lumière Matière, Univ. Lyon I
- Gilles Tarjus, LPTMC, Sorbonne Université
Collaboration :
- Laboratoire Léon Brillouin, UMR12 CEA-CNRS, Centre CEA Saclay (France)
- Institut Lumière Matière, Université de Lyon, Université Claude Bernard Lyon 1, CNRS, F-69622 Villeurbanne, France
- Laboratoire de Physique Théorique de la Matière Condensée, CNRS, Sorbonne Université, 75005 Paris, France.