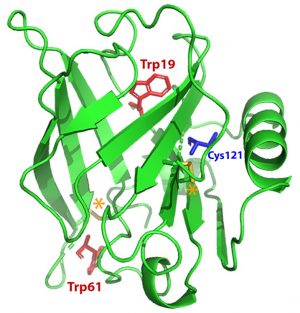
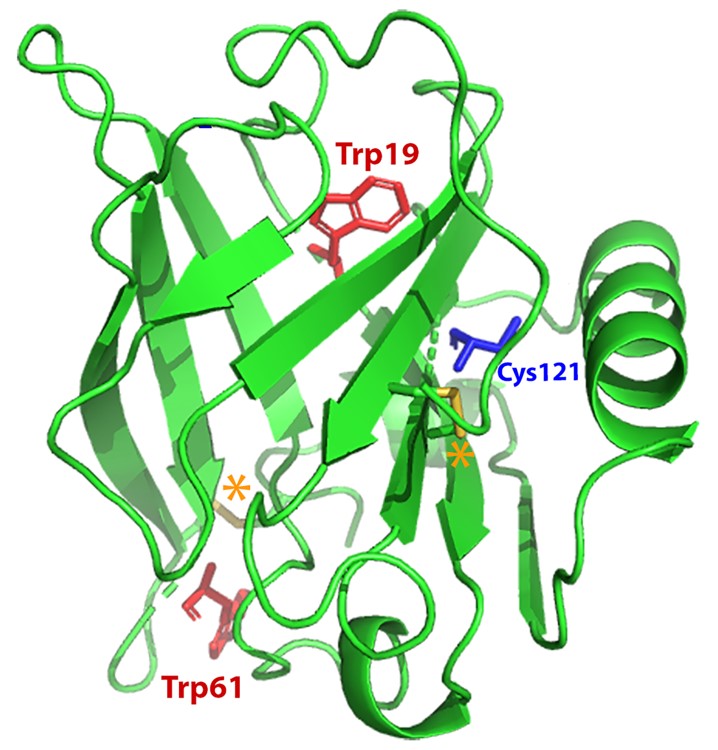
La structure des protéines est en lien étroit avec leur fonction. Ainsi, sonder les états de repliement et d'oligomérisation des protéines est un défi majeur en biologie.
Grâce au développement d’un dispositif spécifique, nous avons montré que l’utilisation de la haute pression (HP), associée à des méthodes de caractérisation structurale, est un outil puissant pour caractériser la struture des protéines et révéler des intermédiaires subtils de dépliement, qui seraient inaccessibles par d’autres méthodes de dénaturation.
Dans le but d'étudier le dépliement des protéines, une nouvelle cellule haute pression (HP) pour des mesures de diffusion de neutrons aux petits angles (SANS) a été récemment développée au LLB (Figure 1) [1]. Sa géométrie plate (et non cylindrique comme usuellement) induit de fortes contraintes mécaniques, mais s’avère nécessaire pour un traitement rigoureux des données et une soustraction correcte du signal important issu de la cellule elle-même. Beaucoup plus résistantes aux hautes pressions que des fenêtres en saphir, l’utilisation de fenêtres métalliques s'est imposée, même si celles-ci absorbent et diffusent une partie des neutrons.
Cette cellule a permis d’atteindre pour la première fois une pression de 600 MPa pour des mesures haute pression in situ de SANS, pression à laquelle la plupart des protéines (même les plus stables comme la myoglobine) se déplient complètement [1].

Cette cellule HP-SANS a en particulier été utilisée pour étudier le dépliement de la β-lactoglobuline bovine (BLG), la principale protéine du lactosérum (ou petit lait). La BLG a une forte propension à se lier à diverses molécules bioactives telles que le rétinol et le resvératrol, deux ligands ayant une affinité et des sites de liaison différents. Leurs effets spécifiques sur les changements conformationnels, tridimensionnels et locaux, de la BLG ont été révélés en combinant des mesures HP in situ de diffusion de neutrons (SANS) et de spectrophotométrie d'absorption UV-visible (Figure 2).
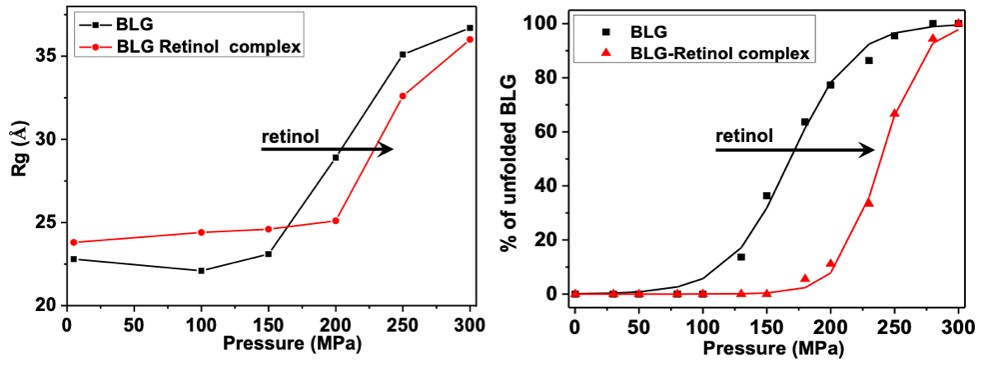
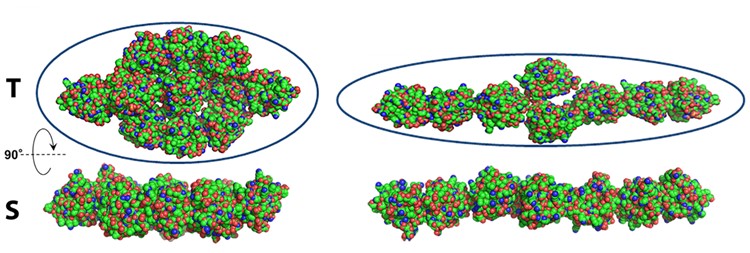
Sous l'effet d'une pression pouvant atteindre 300 MPa, les dépliements partiels et complet de la BLG ont été caractérisés. Contrairement au resvératrol, qui n'induit pas d'effet notable, l'ajout de rétinol stabilise la BLG, en déplaçant la pression de dépliement (Figure 2) et en réduisant l’oligomérisation irréversible de la protéine après avoir été mise sous pression (Figure 3).
Ainsi, comme le montre ce travail, les effets des hautes pressions ouvrent de nouvelles perspectives pour les études structurale et dynamique des intermédiaires de repliement des protéines.
Référence :
« Effect of ligands on HP-induced unfolding and oligomerization of beta-lactoglobulin »
Simeon Minic, Burkhard Annighöfer, Arnaud Hélary, Djemel Hamdane, Gaston Hui Bon Hoa, Camille Loupiac, Annie Brûlet and Sophie Combet, Biophysical Journal 119 (2020).
Contact CEA : Sophie Combet (LLB/MMB)
Collaboration :