

Impression de films minces d’oxydes sur de grandes surfaces pour la photocatalyse et la conversion d’énergie solaire
Frédéric Oswald (NIMBE/LICSEN)
Notre futur énergétique repose sur la conception de procédés innovants, efficaces, durables et peu coûteux permettant la conversion et le stockage d’énergies renouvelables, telle que l’énergie solaire. Dans cette optique, des efforts sont encore à faire dans le développement et la mise en forme de matériaux visant à fabriquer des cellules solaires de 3ème génération. Le choix de la méthode de mise en forme est crucial quand il s’agit d’améliorer l’efficacité globale lors de la fabrication de dispositifs. En règle générale, celle-ci doit permettre de contrôler les principaux paramètres des couches déposées comme la géométrie, l’épaisseur, la morphologie ou encore la rhéologie. Pouvoir modifier précisément ces paramètres doit permettre la fabrication de dispositifs optimisés.
L’impression par sérigraphie est une méthode de dépôt de matériaux fonctionnels sur de grandes surfaces qui donne accès à ces paramètres. Cette technique repose sur l’impression d’une encre à travers un pochoir grillagé. L’épaisseur de la couche formée est alors proportionnelle à la concentration de l’encre et à l’ouverture du grillage. Dans le cas de la conversion d’énergie solaire, l’architecture monolithique des cellules pérovskites autorise la fabrication de cellules solaires mésoscopiques entièrement imprimées. Ce procédé permet de travailler sur des cellules de taille laboratoire, dont les densités de courant excèdent les 20 mA/cm2, pour le développement, mais aussi sur des échantillons dont la taille peut atteindre plusieurs dizaines de cm2 dans le cas de prototypage. Cette architecture est réputée stable sur plusieurs milliers d’heures.

Coupe MEB (Microscopie électronique à balayage) des différentes couches actives imprimées dans le cas d’une cellule monolithique pérovskite, avant imprégnation de l’ensemble par la pérovskite.

La fluorescence femtoseconde pour l’étude de médicaments
Thomas Gustavsson (LIDYL/DICO)
Afin de traiter le diabète, une approche thérapeutique très prometteuse est d’inhiber l’enzyme glycogène phosphorylase (GP). Il est donc primordial de bien caractériser l’interaction inhibiteur-enzyme pour mieux comprendre les critères qui en font un bon inhibiteur. Une équipe dirigée par le Pr. T. Gimisis (Athènes, Grèce) a récemment synthétisé un composé, « GLAC », qui d’un côté montre une grande activité en tant qu’inhibiteur du GP, et d’un autre côté permet un suivi de l’interaction GP-GLAC par spectroscopie optique. La particularité de ce composé réside dans sa spectroscopie très riche, qui permet de distinguer les différentes formes acido-basiques présentes et ainsi ouvre la possibilité de sonder la nature de l’environnement local du site actif.
Dans le cadre d’un contrat LaserLab avec l’équipe de T. Gimisis, nous avons entrepris une étude de l’inhibiteur GLAC en solution aqueuse par spectroscopie de fluorescence résolue en temps, étape nécessaire avant d’étudier le complexe GLAC-GP. Comme illustré sur la figure, le déclin de la fluorescence aux longueurs d’onde plus courtes (courbe bleue) et la montée aux longueurs d’onde plus grandes (courbe rouge) se déroulent d’une façon concomitante avec un temps caractéristique d’une dizaine de picosecondes, ce qui est beaucoup trop lent pour s’expliquer par la dynamique de solvatation. En comparant avec les résultats de calculs TD-DFT, nous avons pu attribuer cette dynamique à une relaxation conformationnelle à l’état excité impliquant les deux liaisons simples qui lient les deux groupements cytosine-acridine. Seuls certains de ces conformères sont réellement fluorescents, les autres se désactivant d’une façon non-radiative. Cette caractérisation de la spectroscopie de l’inhibiteur seul, en absence d’interaction avec l’enzyme, est un premier pas vers l’étude du complexe GLAC-GP à proprement parler. Elle montre que la réponse optique de l’inhibiteur permettra de renseigner sur la conformation choisie, et donc sur les interactions principales dans le site actif de la GP.
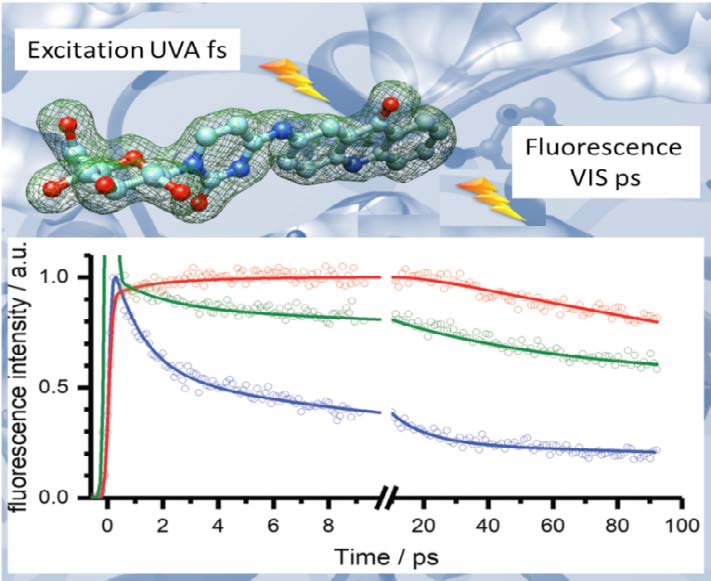
En haut : représentation schématique du composé GLAC constitué d’un chromophore acridine (à droite) et d’un groupement glucose-cytosine (à gauche) qui s’insère dans le site actif de l’enzyme. En bas : Déclins de fluorescence du GLAC en solution aqueuse neutre après excitation à 400 nm. Détection à trois longueurs d’ondes représentatives pour différents conformères : 430 nm (en bleu), 465 nm (en vert), 515 nm (en rouge).



