Sur Terre, l'eau est une substance abondante, dont le cycle d'évaporation – condensation – solidification (transitions vapeur – liquide – solide) relève de l'expérience quotidienne. Les propriétés physiques de l'eau et son diagramme de phase complet sont cependant bien plus complexes que ne le laisse paraitre ces propriétés familières.
L'eau est en effet qualifiée de « liquide anormal » : dans le domaine de surfusion (eau restée liquide en dessous de 273 K), ses propriétés thermodynamiques et de diffusion semblent adopter un comportement critique, avec une divergence de la chaleur spécifique vers 228 K. Autre observation expérimentale : l'existence de deux phases de glace amorphe de densité très différentes (0.94 et 1.17) Pour rationaliser ces propriétés, l’existence d’un Point Critique à Basse Température (PCBT) terminant une ligne de transition entre deux formes d’eau liquide de densités très différentes a été proposée, sans pouvoir être observée jusqu'à présent.
Une collaboration de physiciens (CEA-IRAMIS– Synchrotron Soleil et ILL) s'est intéressée à la physique de l'eau lorsque les molécules d'eau sont contraintes de s’organiser en seulement deux dimensions (2D). Si cette étude ne permet toujours pas de conclure définitivement sur l’existence du PCBT, l’eau en 2D montre des propriétés structurales et dynamiques très originales [1], qui ont une pertinence dans tous les domaines où l’eau se trouve en situation de monocouche : en particulier dans les domaines de la biophysique et industrie alimentaire (transition dynamique des protéines à 220 K), des sciences des matériaux (bétons) et du nucléaire (stockage des déchets à vie longue).
La vérification expérimentale de l’existence du PCBT constitue un véritable défi : l’eau surfondue gèle spontanément en dessous de la température de nucléation homogène, TH = 235 K. Les deux formes de glaces amorphes, LDA (Low Density Amorphous Ice) et HDA (High Density Amorphous ice), qu’il est possible d’obtenir à basse température (< 135 K) subissent une transition de phase et cristallisent au-delà de TX = 150 K (Figure ci-contre). En conséquence, il a, à ce jour, été impossible d’observer expérimentalement de l’eau liquide entre 150 et 235 K (Voir H. Stanley [2, 3]).
Dans de nombreuses applications, en particulier dans le cas important de la corrosion sous contrainte (moteur de la propagation de fissures dans un verre endommagé) ou encore pour l'agro-alimentaire, l'étude de la dynamique des protéines hydratées, l'eau liquide se retrouve confinée à l'échelle nanométrique, qui de plus impose une organisation bidimensionnelle des molécules d'eau. Dans ces conditions, on s'attend tout d'abord à observer un diagramme de phase décalé en température. Le confinement nanométrique permet en effet, de diminuer la température de fusion des matériaux cristallins de plusieurs dizaines de degrés. Ce décalage en température, ΔT, est inversement proportionnel à dpore, la taille caractéristique du pore de confinement (typiquement son diamètre) : ΔT ≈ 1/dpore (effet Gibbs-Thomson). Dans ces conditions, il peut être possible de sonder des états métastables de la matière qui sont thermodynamiquement inaccessibles en volume.
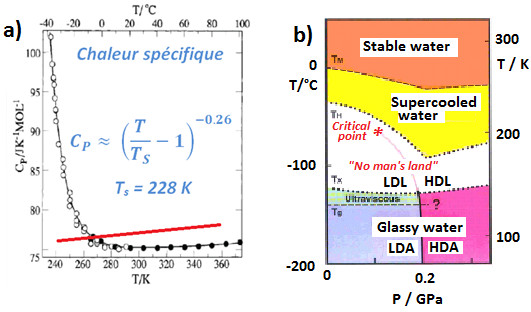
Expérimentalement, le confinement de l’eau au sein de MCM41, un verre poreux de silice, de diamètre extrêmement faible (dpore = 1.4 nm), une situation exaltant l’effet Gibbs-Thomson, est apparu comme une solution idéale pour sonder la physique de l’eau dans la zone inexplorée (50 – 235 K) du diagramme de phase en volume. Plusieurs techniques expérimentales (calorimétrie, diffusion de neutrons, RMN, spectroscopie en Infra-rouge proche et lointain) ont permis de sonder les propriétés d’une monocouche d’eau à la surface du Vycor, un verre poreux de silice (210 m2/g, taille des pores 3.5 nm). Pour des pores de cette taille nanométrique, la porosité n’est plus une grandeur pertinente, l'eau étant adsorbée sous forme de monocouche moléculaire (i.e. on n’entre pas de la cadre d’un effet Gibbs-Thomson). Seul compte ici l’interaction directe des molécules d'eau avec la surface de la silice et avec les molécules voisines dans le plan.
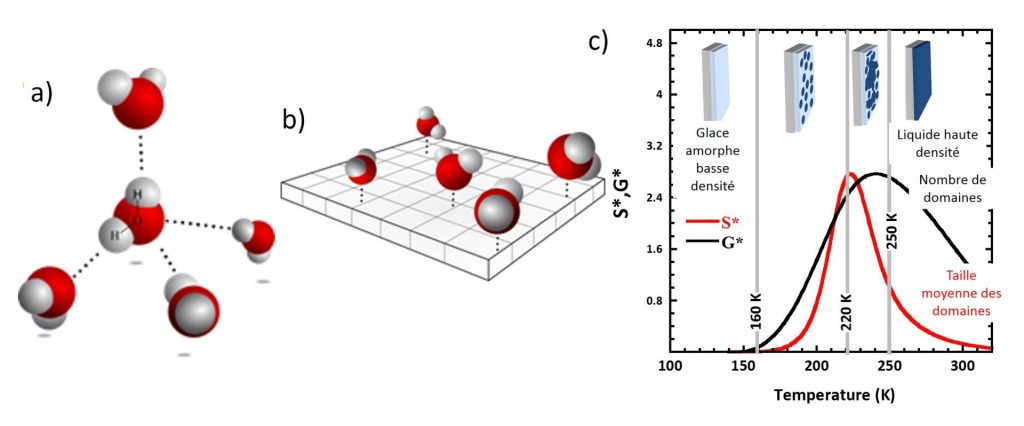
L'ensemble des résultats obtenus permettent d'obtenir une description cohérente du système entre 160 et 250 K : À basse température (T < 160 K) l’eau interfaciale est solide et amorphe avec une faible densité (en bleu clair sur la Fig.2c). Elle se caractérise par un réseau planaire désordonné de liaisons H, dont l'évolution peut être suivie dans le cadre d'un modèle analytique de percolation en champ moyen. A Tg= 160 K l’agitation thermique devient suffisante pour induire une mobilité moléculaire : des domaines transitoires de haute densité (en bleu foncé sur la figure 2-c) apparaissent alors. Ils sont composés de molécules parvenant à engager 4 liaisons H avec leur voisines. Lorsque la température augmente, à la fois le nombre (G*, sur la figure ci-contre) et la taille (S*) des ilots augmentent. À 220 K le seuil de percolation est atteint, la surface étant totalement couverte à 250 K (Figure 2-c). Cette richesse de comportement est attribuée à l’augmentation très significative de l’entropie des molécules d’eau, induite par la frustration de la géométrie tétraédrique 3D locale « naturelle », dans les conditions de la réduction de dimensionnalité (3D à 2D).
Ainsi, si le point critique recherché n'a pas été formellement mis en évidence, une transition structurale a pu être identifiée, qui suit assez fidèlement le diagramme de phases proposé dans la cadre théorique du PCBT. Cependant, dans le cas d’un de confinement extrême étudié, l’interaction des molécules avec la surface n’est plus négligeable : sonde-t-on alors les propriétés de l’eau volumique ou une autre forme d’eau : l’eau interfaciale ? Cette exploration de la physique de l'eau en 2D montre ainsi un comportement thermodynamique riche et complexe, dont l'exploration est encore loin d'être achevée.
| [1] Competing coexisting phases in 2D water J.-M. Zanotti, P. Judeinstein, S. Dalla-Bernardina, G. Creff, J.-B. Brubach, P. Roy, M. Bonetti, J. Ollivier, D. Sakellariou, and M.-C. Bellissent-Funel, Sci. Rep., 6, 25938 (2016). |
 |
|
[2] H. E. Stanley in Hydration process in Biology, M.C. Bellissent-Funel (Ed.), Nato Science Series – Serie A, vol 305, IOS Press (1999). [3] P.G. Debenedetti & H.E. Stanley H.E., Supercooled and glassy water, Physics Today 56, 6, 40 (2003). |
Contact CEA-IRAMIS : J.-M. Zanotti (LLB/Axe Soft Complex Matter / Groupe Spectroscopie)
Communiqué de l'ILL : « Competing coexisting phases in two-dimensional water ».
Collaboration :
- P. Judeinstein, M.-C. Bellissent-Funel : IRAMIS/LLB, CEA, CNRS, Université Paris-Saclay, CEA Saclay, 91191 Gif-sur-Yvette Cedex, France
- D. Sakellariou : IRAMIS/NIMBE, CEA, CNRS, Université Paris-Saclay, CEA Saclay, 91191 Gif-sur-Yvette Cedex, France
- M. Bonetti : IRAMIS/SPEC, CEA, CNRS, Université Paris-Saclay, CEA Saclay, 91191 Gif-sur-Yvette Cedex, France.
- S. Dalla-Bernardina, G. Creff, J.-B. Brubach, P. Roy : Synchrotron SOLEIL, L’Orme des Merisiers, BP 48, Gif-sur-Yvette Cedex F-91192, France.
- J. Ollivier : Institut Laue Langevin, 38042 Grenoble CEDEX, France.