L’hadronthérapie est une technique de radiothérapie qui met en jeu des faisceaux d’ions accélérés de grande énergie. Cette technique, peu répandue en Europe, présente un avantage déterminant par rapport à la radiothérapie conventionnelle en combinant les propriétés radiobiologiques des particules de haut TEL (Transfert d’Energie Linéique) et un ciblage précis, permettant la prise en charge des tumeurs radio-résistantes ou de localisation délicate. L’évaluation des dommages radio-induits dans des conditions mimant au mieux la réalité biologique d’un tissu humain est alors essentielle pour définir les protocoles de soins.
La mise au point de modèles tridimensionnels de cartilage et de chondrosarcome reconstitués in vitro (1) ont permis à l’IRCM (LARIA) associé à l’IRAMIS (CIMAP), à l’IBITEC-S (SBIGEM) et à l’Université de Franche Comté (UMR6249) de disposer de systèmes d’évaluation pertinents pour leur étude en hadronbiologie. Ainsi, il a pu être montré que lors d’une exposition à des ions carbone accélérés, le risque de sénescence radio-induite de tissus sains adjacents à une tumeur est comparable à celui d'une radiothérapie conventionnelle. Un tel résultat permet d’envisager l’établissement de protocoles d’hadronthérapie plus efficace sur les tumeurs, tout en préservant les tissus sains du patient. La mise au point d’un modèle de tumeur intégrée à un tissu sain par bio-imprimante 3D devrait à l’avenir permettre une exploration plus poussée des échanges entre tissu normal et pathologique.

La radiothérapie a une place essentielle dans l’arsenal thérapeutique du cancer principalement à visée curative, mais aussi parfois à visée palliative ou encore symptomatique. En France, 380 000 nouveaux patients sont pris en charge chaque année pour un cancer, dont environ 180 000 sont traités par radiothérapie. Cependant, malgré des progrès indéniables, certains traitements du cancer restent des échecs du fait d’une agressivité singulière, d’une localisation délicate ou encore d’une radiorésistance importante. De plus, près de 5% des patients adultes dont le traitement est un succès vont subir des séquelles importantes. Dans le cas d’une radiothérapie pédiatrique, le taux de séquelles (dont les cancers radio-induits) sera bien plus important. Une meilleure compréhension des mécanismes biologiques concourant à l’émergence de ces séquelles est donc essentielle,pour pouvoir les anticiper, voire les limiter et ainsi améliorer la qualité de vie des patients guéris ou en rémissions.
Le principe d’utilisation du dépôt d’énergie spécifique d'ions accélérés dans le traitement du cancer fut initialement décrit par Robert Wilson en 1946. Les premiers patients furent traités par cette technique en 1954 aux Etats-Unis (Radiation Laboratory, Berkeley) et en 1957 en Europe (Gustaf Werner Institute, Uppsalaa). Pendant plusieurs décennies, l’hadronthérapie fut limitée à l’adaptation de salles de traitement dans des centres de recherche en physique nucléaire. Les développements technologiques des années 80 autorisèrent la conception d’accélérateurs plus compact (cyclotron) compatible avec une utilisation en routine clinique. Si l’hadronthérapie par proton (protonthérapie) connu rapidement un succès mondial en particulier aux Etats-Unis, l’hadronthérapie par ions carbone resta longtemps limité géographiquement au Japon, avant de connaitre une récente diffusion en Europe (Heidelberg, Pavie et Vienne). Aujourd’hui, le projet Archade érige à Caen le premier centre français de traitement et de recherche en hadronthérapie, en bénéficiant de l’expertise mondialement reconnue du GANIL (Grand Accélérateur National d’Ions Lourds, laboratoire CEA-CNRS) et des laboratoires de recherche associés (CIMAP, LARIA).
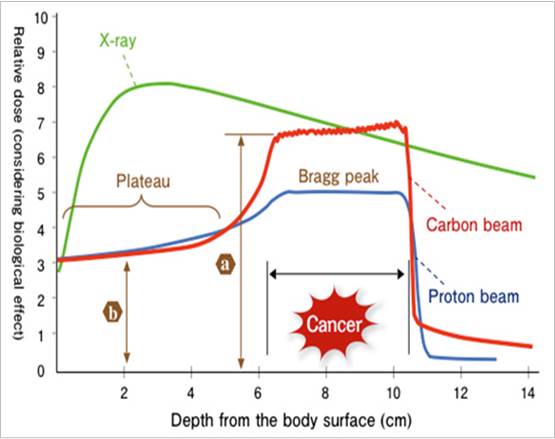
Si l'hadronthérapie présente l'avantage d'une dose d'irradiation, pondérée de son effet biologique, plus faible que pour les rayons X, l'exposition des tissus sains, lors d’un traitement par ions carbone, doit toujours être minimisée (figure 1). La dose biologique à laquelle sera exposée la tumeur correspondra au produit de la dose physique délivrée (2 Gy à un TEL – Transfert d’Energie Linéique – moyen de 90 keV/µm) par l’efficacité biologique des ions (2 à 3 fois supérieure à celle des photons d’une radiothérapie conventionnelle). Les courbes de la figure ci-contre montrent que la dose biologique déposée par les ions carbone dans les tissus sains (au niveau du premier plateau) sera très inférieure à celle déposée au niveau de la tumeur (environ 30 keV/µm). Evaluerl’impact biologique de cette exposition spécifique (ions carbone 75 to 95 MeV/u, dose de 2 Gy avec un TEL de 30 keV/µm) dans les tissus sains situés en amont de la tumeur est indispensable pour évaluer le risque de séquelles radio-induites.
Ainsi, lors du traitement de tumeurs osseuses, des cartilages articulaires sains sont présents sur le trajet des faisceaux d’ions carbone. La mise au point de modèles tridimensionnels de cartilage et de chondrosarcome (tumeur osseuse issue du cartilage) reconstitués in vitro et leur validation pour l’hadronbiologie (1) ont permis à l'équipe LARIA de l’IRCM de disposer de systèmes d’évaluation pertinents pour ces tissus. Autre avancée importante : l’identification d’un nouveau bio-marqueur par une équipe de l’IBITEC-S qui a permis l’analyse fine de la sénescence radio-induite, facteur important de dégradation du cartilage articulaire chez les patients traités par radiothérapie.
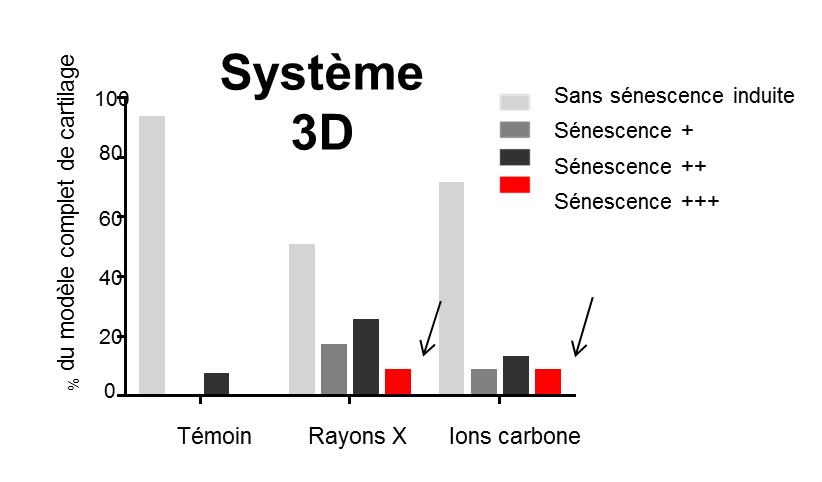
Expérimentalement, des ions carbone de TEL correspondant à l’exposition des tissus sains lors d’une hadronthérapie (~30 keV/µm) ont été utilisés grâce à la détermination par le LARIA et l’Université de Franche-Comté du profil du dépôt de dose dans une structure modèle tridimensionnelle . Bien que, dans ces conditions et pour des systèmes de culture 2D, l’efficacité biologique relative des ions carbone comparée aux rayons X a été évaluée à 2,6, une plus forte induction de sénescence radio-induite n’a pas été retrouvée dans les modèles 3D de cartilage (figure ci-dessous) : pour la même dose physique, les ions carbone (TEL ~30 keV/µm ) n'induisent pas un risque de sénescence supérieur à celui des rayons X. Les résultats obtenus au cours de cette étude avec les modèles 3D montre ainsi que l’effet biologique relatif des ions accélérés, calculé à partir des résultats sur des cellules en culture 2D, est clairement surévalué.
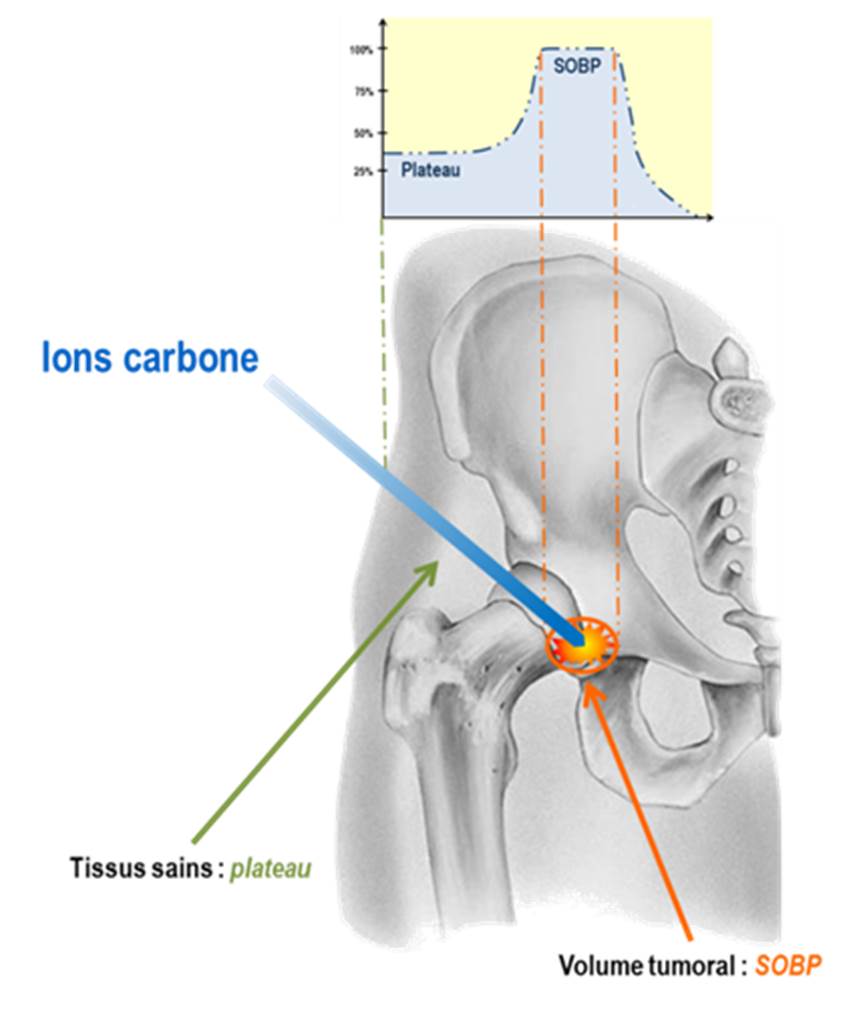
Un tel résultat permettra de définir des protocoles d’hadronthérapie mieux adaptés au traitement de cancer radiorésistant comme le chondrosarcome, tout en préservant au mieux les tissus sains adjacent des patients. Ces résultats s’inscrivent dans le contexte du développement du centre de recherche et de traitement par hadronthérapie ARCHADE dont la construction a débuté à Caen.
[1] “In vitro engineering of human 3D chondrosarcoma: a preclinical model relevant for investigations of radiation quality impact”,
D. H. Hamdi, S. Barbieri, F. Chevalier, J.-E. Groetz, F. Legendre, M. Demoor, P. Galera, J.-L. Lefaix and Y. Saintigny, BMC Cancer 15 (2015) 579. DOI :
[2] “Comparable senescence induction in 3D human cartilage model by exposure to therapeutic of X-rays or C-ions”,
D. H. Hamdi, F. Chevalier, J.-E. Groetz, F. Durantel, J.–Y. Thuret, C. Mann, Y. Saintigny, Int. Journal of Radiation Oncology, biology, in press.
Contact CEA : Yannick Saintigny (LARIA – SREIT/IRCM & CIMAP/IRAMIS)
Collaboration :
- LARIA – SREIT/IRCM & CIMAP/IRAMIS. DRF/CEA. GANIL Bd Henri Becquerel, 14076 Caen, France.
- CIRIL – CIMAP/IRAMIS. DRF/CEA. GANIL Bd Henri Becquerel, 14076 Caen, France.
- SBIGeM – CNRS-FRE3377/IBITECS. DRF/CEA. Saclay, 91191 Gif sur Yvette, France
- UMR-6249 – Université de Franche-Comté, Besançon, France.

