Un des objectifs de la physico-chimie est de suivre de façon fine et détaillée les chemins réactionnels des différents composants au cours d'une réaction chimique. Pour ceci de nombreuses techniques ont été mises en point : études en cellules, en jets effusifs ou supersoniques, spectroscopie laser, spectrométrie de masse…
Une technique originale « Cluster Isolated Chemical Reaction » (CICR) a été développée par le groupe de Dynamique Réactionnelle du LIDyL/LFP à des fins d'études de spectroscopie et de dynamique réactionnelle [1]. Elle consiste à observer ces réactions sur un nanoréacteur, constitué d'un simple agrégat de van der Waals. Elle a été récemment appliquée avec succès au cas d'une simple goutte d'hélium refroidie, qui constitue un milieu assez fascinant, car réunissant très basse température (0.37 K), superfluidité et taille finie. Cette taille finie permet de piéger et d'isoler un nombre contrôlé de molécules et de stabiliser des complexes intermédiaires de très faible stabilité. L'étude de telles molécules apporte des informations d'une très grande précision sur les surfaces de potentiel intramoléculaire, permettant d'améliorer la fiabilité des modèles associés.
Issue des techniques classiques d'étude en jet moléculaire, la technique » Cluster Isolated Chemical Reaction » CICR, consiste à étudier des molécules piégées par des agrégats de gaz rares (néon, argon…) ou moléculaires (azote, méthane…). La basse température des gouttelettes d'hélium et leur caractère superfluide permet de former et de stabiliser des complexes moléculaires de très faible stabilité, difficiles à obtenir en phase gazeuse et non observables à température ambiante, et ceci sans être gêné par la viscosité d'un « solvant ».
- les gouttelettes d'hélium interagissent très peu avec les molécules qui y sont hébergées et elles les maintiennent à une température très basse. Une spectroscopie ro-vibrationnelle de grande précision, proche de celle de la molécule isolée, est alors possible. Avantage supplémentaire, la basse température simplifie considérablement les spectres, car l'état initial est celui de plus basse énergie. Ceci est particulièrement intéressant lorsque plusieurs isomères coexistent (cas de grosses molécules organiques et bio-organique : sucres, …), car une information structurale pourra être obtenue sur chaque isomère.
- Une interaction faible existe néanmoins entre la gouttelette, qui est un fluide quantique, et les molécules hébergées, ce qui ouvre la porte à des études dynamiques originales de réactions chimiques au sein d'un solvant quantique.
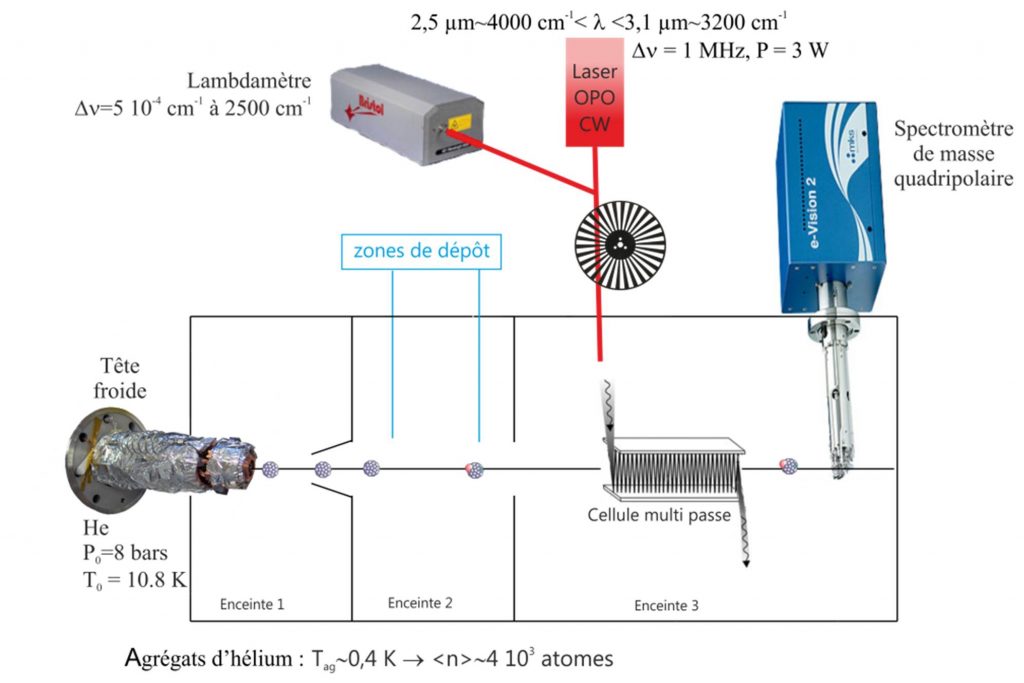
Un schéma du dispositif expérimental « Gouttelium » est représenté Figure 1. Les agrégats d’hélium sont formés par condensation dans un jet supersonique (conditions génératrices: T0=10.8 K, P0=8 bar, D*=5 µm). Leur taille moyenne est estimée à quelques milliers d'atomes. Après extraction par un écorceur, le jet d’agrégats d’hélium traverse une cellule contenant une faible pression de molécule d'acétylène. Lors des collisions, ces molécules se déposent sur les agrégats [1]. Après la cellule, le jet d’agrégats poursuit sa trajectoire et croise un jet effusif d'atomes d'argon. Grâce à ces deux zones de dépôt, il est possible de générer des agrégats contenant un nombre contrôlé de molécules d'acétylène et d'atomes d'argon. Ces deux espèces migrent et s’associent pour former un complexe car leur énergie d’association (de l'ordre de 17 meV [2] (soit 140 cm-1 ou 200 K) est plus élevée que la température de l’agrégat (0.032 meV, soit 0.37 K).
Le jet d'agrégat, ainsi formé, entre ensuite dans l'enceinte d'analyse, où l'aggrégat dopé peut être excité par laser et le résultat de cette excitation est analysé par spectrométrie de masse. Le laser OPO (Oscillateur Paramètrique Optique) infrarouge est accordable entre 2,5 et 3,1 µm. Pour compenser les faibles forces d'oscillateur dans ce domaine de longueur d'onde, le faisceau laser doit être le plus puissant possible (3 W) et une cellule multi-passe (x 30) permet d'augmenter le volume d'interaction entre le jet d'agrégats et le faisceau laser (~50 mm3). Le flux d'agrégats transmis est mesuré par un spectromètre de masse quadripolaire, accordé sur la masse de l'ion He2+, les dimères d'hélium ne pouvant être issu que d'un agrégat froid.
La spectroscopie infrarouge des agrégats d'hélium dopés est basée sur le fait qu'une excitation ro-vibrationnelle de la molécule déposée (ici l'acétylène), implique une énergie de plusieurs centaines voire milliers de cm-1 (~120 meV), à comparer à l'énergie de liaison d'un atome d'hélium avec son agrégat : 5 cm-1 (ou 0.62 meV) [3]. L'énergie ro-vibrationnelle d'une molécule d'acétylène étant rapidement transférée à l'agrégat d'hélium, la relaxation d'une seule molécule excitée provoquera l'évaporation de centaines d'atomes d'hélium. Pendant le temps d'interaction, la molécule solvatée a le temps d'effectuer plusieurs cycles d'absorption-relaxation, provoquant ainsi une forte évaporation de l'agrégat. Ainsi, le flux d'agrégats transmis est fonction de la longueur d'onde du laser. Une forte réduction du flux d'agrégats est observée lorsque le laser est accordé sur une transition moléculaire de la molécule solvatée.
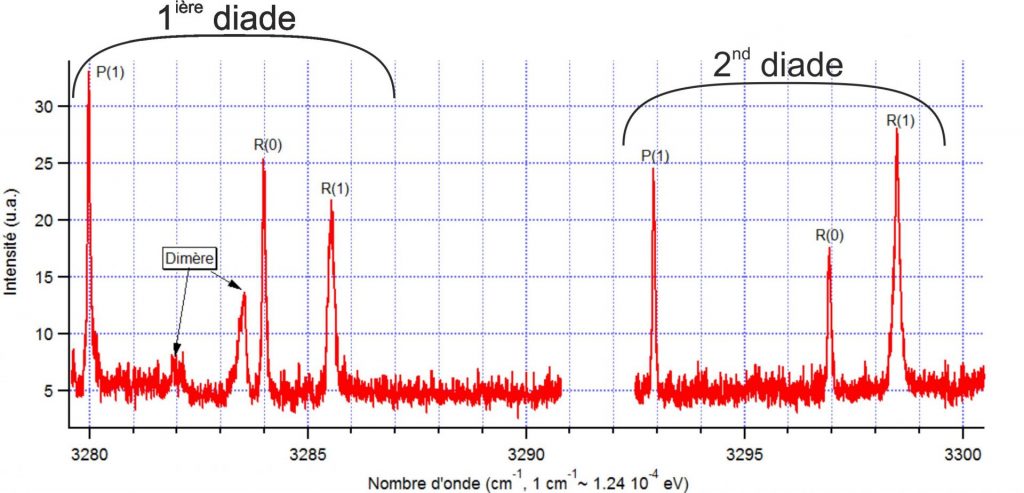
La Figure 2 présente le premier spectre d'absorption infrarouge de l'acétylène obtenu sur le dispositif Gouttelium. Il est composé de deux séries de raies ro-vibrationnelles (P(1), R(0) et R(1)) appelées diade (cf. Figure 2), qui révèlent un couplage (résonance de Fermi) entre un mode normal de vibration (ν3) et une combinaison de mode normaux de vibration (ν2+ν4+ν5).
Notre travail actuel consiste à comprendre l'évolution de ce type de résonance lors d'une perturbation des états vibrationnels de la molécule d'acétylène. L'utilisation des agrégats d'hélium permet de former des complexes acétylène-argon avec un nombre d'atomes d'argon parfaitement contrôlé. Grâce à la technique CICR, il est possible de connaître la stœchiométrie des complexes associés à chaque raie d'absorption. Le complexe, sans réelle liaison chimique, est dit « mou » et les mouvements de vibration intramoléculaire fortement anharmoniques permettent d'obtenir des informations détaillées sur la surface de potentiel, ainsi que sur les interactions entre les états vibrationnellement excités internes à la molécule et les modes de van der Waals (avec l'argon).
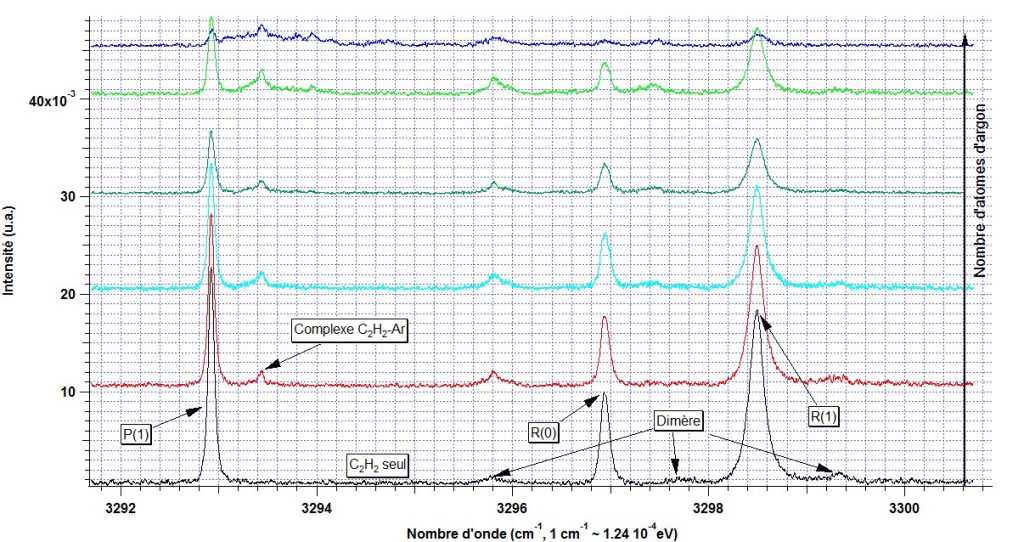
La Figure ci-dessus présente les premiers spectres d'absorption infrarouge du complexe acétylène-argon obtenu sur le dispositif Gouttelium, en fonction du nombre d'atomes d'argon. L'analyse des spectres doit permettre de comprendre l'évolution des différentes bandes moléculaires et d'attribuer celles provenant des complexes à 1, 2 ou plus atomes d'argon. On observe ainsi l'évolution de la résonance de Fermi en présence de plus en plus de perturbateurs.
Comme l'illustre l'étude des complexes acétylène-argon, le dispositif construit permet de réaliser une spectroscopie très fine de complexes moléculaires de très faible stabilité. Les spectres ro-vibrationnels de très haute qualité, car obtenus à très basse température, apportent des informations très fines sur les potentiels intramoléculaires, indispensables pour obtenir des modélisations fiables des surfaces de potentiel moléculaires pour décrire les mécanismes détaillés de réactions chimiques élémentaires.
Une étude plus approfondie des complexes de van der Waals acetylene- gaz rare (Ne, Ar, Kr) peut être trouvé dans [4] (voir figure 4) et [5] .
Références :
[1].Cluster isolated chemical reactions, J. M. Mestdagh, M. A. Gaveau, C. Gee, O. Sublemontier, J. P. Visticot, International Reviews In Physical Chemistry 16, 215 (1997).
[2].The intermolecular potential of Ar-acetylene. Information from infrared and microwave spectroscopy, A. E. Thornley, J. M. Hutson, Chemical Physics Letters 198, 1 (1992).
[3].Successive capture and coagulation of atoms and molecules to small clusters in large liquid helium clusters, M. Lewerenz, B. Schilling, J. P. Toennies, Journal of Chemical Physics 102, 8191 (1995).
[4].Large Amplitude Motion within Acetylene-Rare Gas Complexes Hosted in Helium Droplets, M. Briant, A. Viel, E. Mengesha, M.-A. Gaveau, B. Soep, J.-M. Mestdagh, P. Jamet, J.-M. Launay, L. Poisson, Physical Chemistry Chemical Physics 21, 1038 (2019).
[5].Large amplitude motion of the acetylene molecule within acetylene-neon complexes hosted in helium droplets, M. Briant, E. Mengesha, P. de Pujo, M. A. Gaveau, B. Soep, J. M. Mestdagh, L. Poisson, Physical Chemistry Chemical Physics 18, 16414 (2016).
Contact CEA-LIDyL-LFP : Marc Briant.