La découverte de nouveaux catalyseurs est un des axes majeur de la recherche chimie. Dans ce cadre, les études de réactivité chimique de composés spécifiques des métaux f (actinides et lanthanides) présentent un grand intérêt.
Les composés sandwichs (C8H8)2Mf, et leurs dérivés anioniques [(Cot)2Mf]─, (Mf désignant un atome lanthanide ou actinide possédant des électrons f) sont des espèces de géométrie linéaire présentant généralement une très faible réactivité. Dans une étude comparative entre l'uranocène (C8H8)2U, connu pour sa grande stabilité et son inertie chimique, et son analogue du thorium (C8H8)2Th (thorocène), une grande différence de comportement chimique est observée. Au contraire de l’uranocène, le thorocène réagit très facilement avec des bases de Lewis neutres monodente ou bidente (L) [i] pour donner les produits d’additions (Cot)2Th(L) où le fragment thorocène est coudé. La facilité de cette réaction est stupéfiante, faisant voler en éclat le dogme établissant que ces espèces ne peuvent pas piéger des ligands et ne peuvent exister qu’en configuration linéaire. Dans ces nouveaux composés coudés, le changement de géométrie est promesse de nouvelles réactivités. Des études de chimie quantique (DFT) ont été menées pour tenter d’expliquer l’origine de cette différence de comportement entre les complexes d’uranium et de thorium.
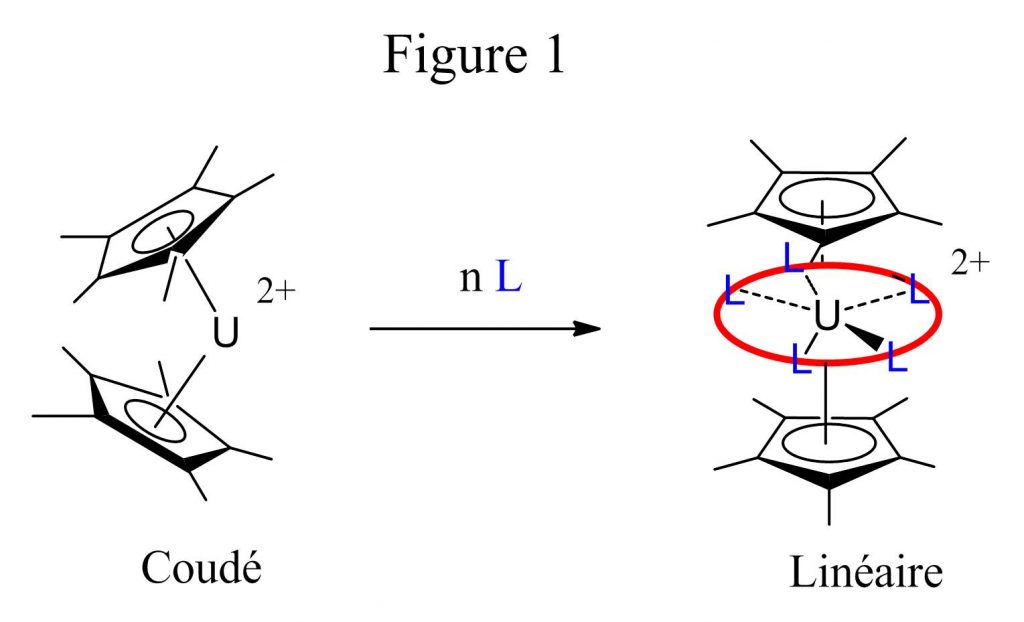
Cette étude s’inscrit dans le cadre des travaux du Laboratoire de Chimie de Coordination des Eléments f (LCCEF) de l'IRAMIS/SIS2M, sur le changement de géométrie de composés extrêmement courants, les « métallocènes »[ii], qui comportent deux ligands aromatiques cycliques anioniques (anions C5R5─ ou C8H82─). Le contrôle de la géométrie de ces composés est essentiel pour moduler leurs propriétés physico-chimiques et leurs potentialités catalytique, et constitue un véritable défi synthétique. Récemment, nous avons ainsi précédemment montré la possibilité de linéariser des espèces coudées du type (C5Me5)2U, par addition de ligands, pourt former une nouvelle classe de métallocènes, pour l’instant spécifique de l’uranium (figure 1).[1] En suivant la même stratégie, nous avons cherché à couder des espèces linéaires des actinides, les « actinocènes » (C8H8)2An (An =U, Th), réputés pour leur rigidité structurale.
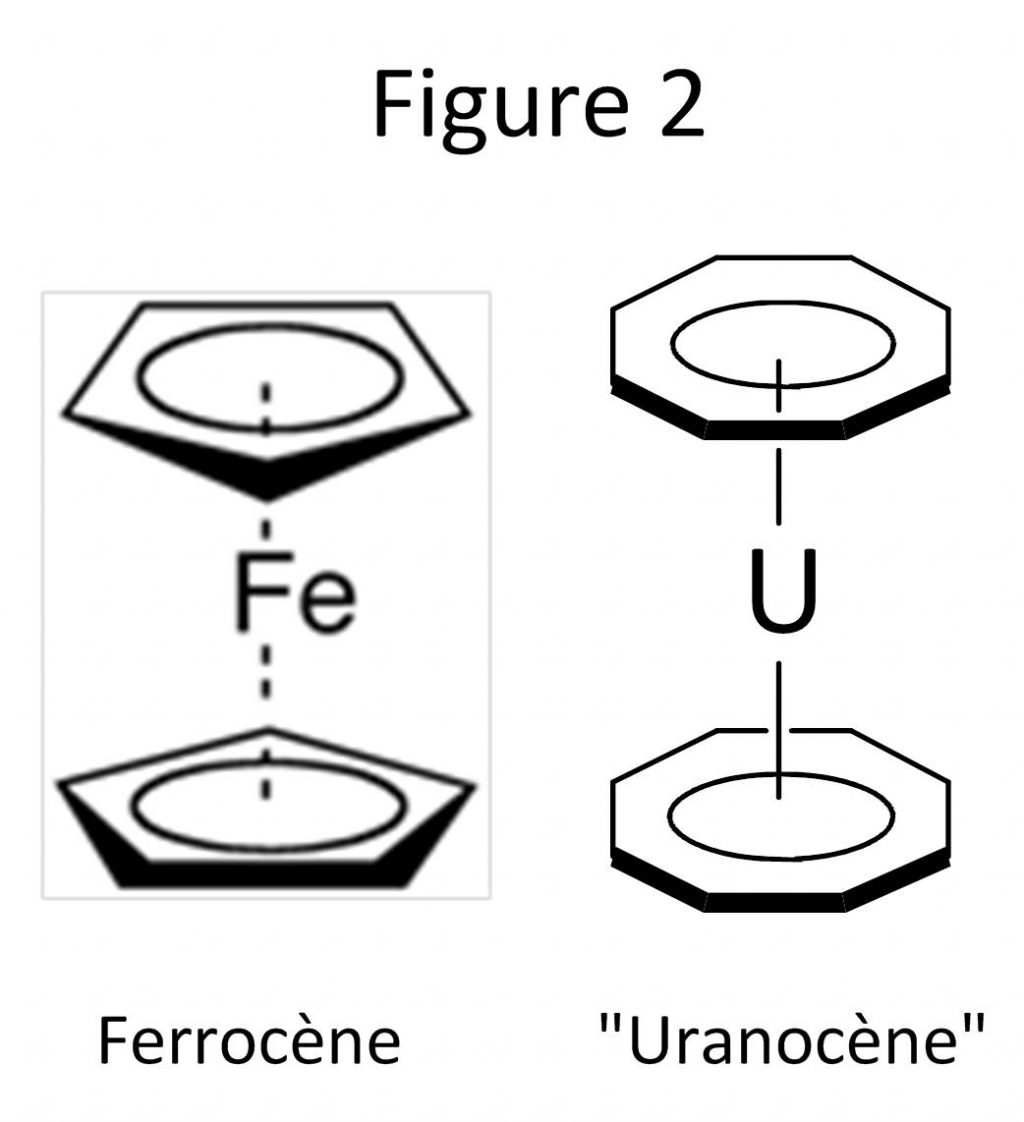
Peu après sa prédiction théorique, la découverte de l’uranocène ((Cot)2U, Cot = dianion cyclo-octatetraene = C8H82─) en 1968 a constitué un évènement de grande portée en chimie de coordination. En plus d’être vu comme l’analogue du ferrocène ((C5H5)2Fe),[2] premier complexe sandwich à l’origine du développement de la chimie organométallique et de bouleversements majeurs dans le domaine de la catalyse, l’uranocène, constitué d’un ion U4+ pris en sandwich par deux ligands aromatiques Cot (Figure 2), a suscité l’enthousiasme des chimistes et des théoriciens. La stabilité remarquable de ce composé linéaire a été attribuée à l’implication des orbitales 5f/6d et la formation de liaisons U–Cot relativement covalentes.[3] Cette compréhension de la nature de l’interaction actinide ligand est un sujet crucial, notamment dans le domaine du nucléaire, pour l’extraction sélective des ions. Malgré les évolutions notables des techniques et des moyens de calculs, elle reste encore floue et le degré de covalence de la liaison U–Cot fait toujours débat.
Rapidement, cette nouvelle classe de composés sandwich s’est étendue à la formation d’analogues avec les ions M3+ et M4+ des actinides (Th, U, Pu, Np, Pa) et des lanthanides, mais leurs réactivités limitées et l’impossibilité pour ces espèces de fixer un ligand supplémentaire ont été expliquées par l’inaccessibilité du centre métallique protégé par ses deux ligands Cot en position parallèle.
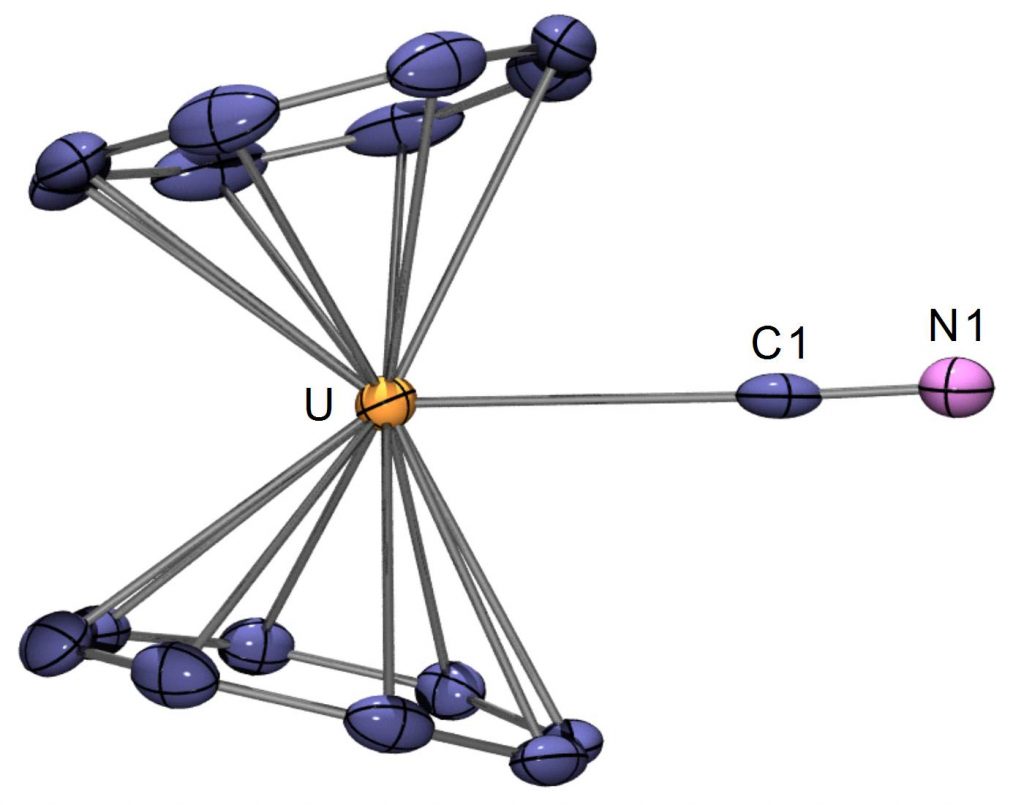
Cette affirmation a été une première fois démentie en 2008 avec la démonstration que le ligand cyanure CN─, fortement coordinant et de petite taille, pouvait écarter les deux Cot et accéder ainsi à l’ion métallique (Figure 3).[4] Ce premier composé comportant un fragment (Cot)2U coudé est néanmoins resté un cas isolé, l’uranocène ne réagissant pas avec de nombreuses autres molécules anioniques ou neutres.
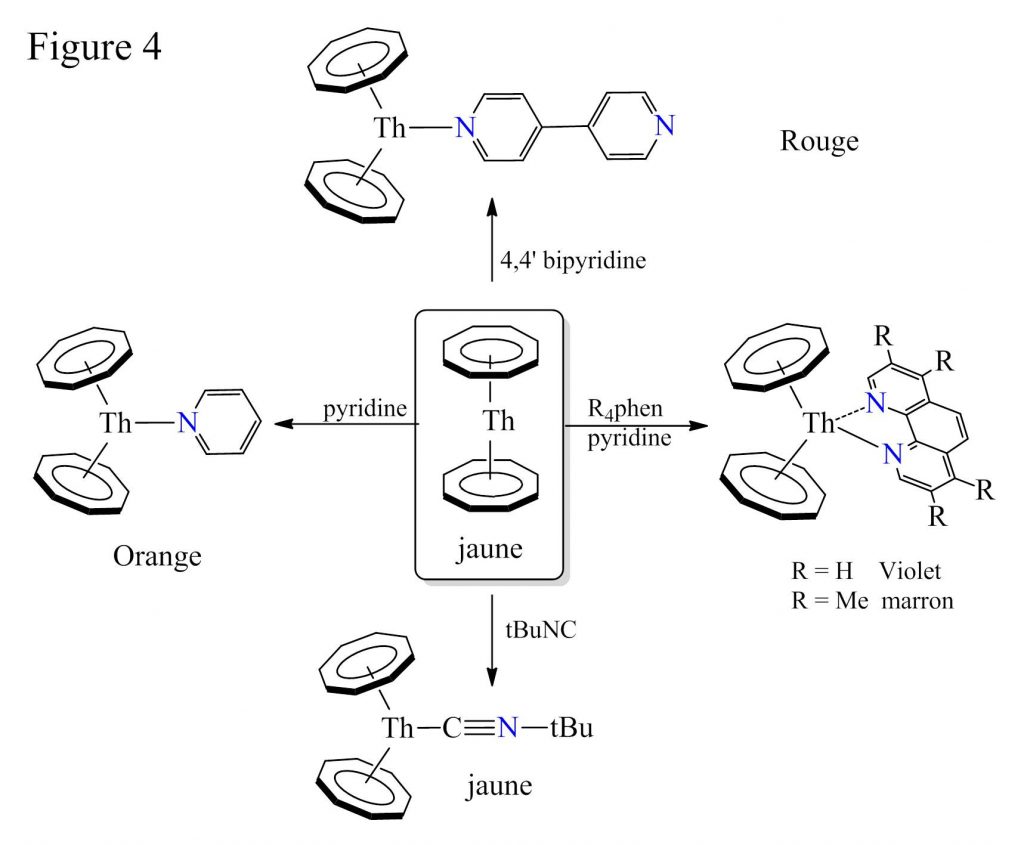
Dans la présente étude, l’ion U4+ est remplacé par Th4+, et ce choix s’est avéré crucial.[5] Bien que de tailles similaires, les deux ions actinide possèdent des orbitales 5f disponibles mais des configurations électroniques différentes (Th4+: +: [Rn] 6d0 7s0 5f0 ; U4+: [Rn] 5f3 6d1 7s2 5f2) susceptibles de mener à des comportements chimiques distincts. La comparaison de la réactivité de (Cot)2U et (Cot)2Th montrent, de façon surprenante, combien il est aisé de modifier l’arrangement linéaire du thorocène pour le transformer en dérivés coudés (Cot)2Th(L) par simple addition de molécule organiques neutres (Figure 4). La réaction avec des ligands bidentes [i] montre même que deux sites de coordination sont potentiellement disponibles sur un fragment (Cot)2Th coudé. Ces transformations sont particulièrement visuelles avec les molécules aromatiques azotées qui mènent à des composés fortement colorés (rouge, violet, marron…, voir figure).
Des études de chimie quantique (DFT) sur l’uranocène et le thorocène ont été réalisées afin de révéler le ou les effets à l’origine de ces différences de comportements. Néanmoins, si les calculs reproduisent bien la thermodynamique de ces réactions de complexation, les résultats, similaires pour l’uranium et le thorium, ne reflètent pas l’expérience.
Au final, à travers la réactivité de systèmes moléculaires simples que sont les actinocènes, l’importance du centre métallique (Th4+ et U4+) qui induit des comportements chimiques notablement distincts a été démontrée. Ce travail offre de nouvelles perspectives réactionnelles et théoriques en vue d’une connaissance plus approfondie de la chimie des éléments f. L’exploration de la réactivité du thorocène sera poursuivie et étendue aux analogues [(Cot)2Mf]q─ (q= 0,1) des actinides et des lanthanides, dans le but d’exhiber les potentialités chimiques de cette série de composés et de tirer des comparaisons utiles pour juger de l’influence de la participation des orbitales f, du rôle du nombre d’électrons f et de la nature de l’interaction métal-ligand.
Références :
[1] a) « An unprecedented type of linear metallocene with an f-element«
J. Maynadié, J.-C. Berthet, P. Thuéry, M. Ephritikhine, J. Am. Chem. Soc., (2006), 128, 1082;
b) « The crucial role of the f electrons in the bent or linear configuration of uranium cyanido metallocene« ,
J. Maynadié, N. Narros, J.- C. Berthet, P. Thuéry, L. Maron, M. Ephritikhine, Angew. Chem., Int. Ed., (2007), 46, 2010-2012.
Voir aussi : Brèves du DRECAM (2006) « Une nouvelle classe de complexes « sandwich » avec les actinides« , J. Maynadié, J.- C. Berthet, P. Thuéry, M. Ephritikhine.
[2] « At least 60 years of ferrocene: the discovery and rediscovery of the sandwich complexes«
H. Werner, Angew. Chem., Int. Ed., (2012), 51, 6052
[3] « Uranocene. the first member of a new class of organometallic derivatives of the f elements«
D. Seyferth, Organometallics (2004), 23, 3562
[4] « Bending of “Uranocene” ((η8-C8H8)2U): synthesis and crystal structure of the cyanido complex [(η8-C8H8)2U(CN)][NEt4] »
J.-C. Berthet, P. Thuéry, M. Ephritikhine, Organometallics, (2008), 27, 1664
[5] J. C. Berthet, P. Thuéry, N. Garin, J. P. Dognon, T. Cantat, M. Ephritikhine, J. Am. Chem. Soc., accepté pour publication.
Contact : Jean-Claude Berthet, IRAMIS/SIS2M.
[i] Un ligand est un atome, un ion ou une molécule portant des fonctions chimiques lui permettant de se lier à un cation métallique. Les molécules portants plusieurs fonctions chimiques pouvant se lier au cation métallique sont des ligands polydentes.
[ii] Métallocène : complexe organométallique dans lequel un métal de transition (Fe, Ru, Os, ..) est lié à deux ligands aromatiques cycliques à 5 atomes de carbone disposés de part et d'autre. Le premier exemple est le ferrocène (C5H5)2Fe. Ce terme est aussi employé pour des complexes présentant une géométrie coudée et a été extrapolé aux complexes bis(cyclo-octatétraényliques) comme l'uranocène, (C8H8)2U. Certains métallocènes catalysent la polymérisation des oléfines et ont trouvé des applications industrielles. Du fait de leur rendement élevé, les métallocènes sont des systèmes catalytiques d’avenir.