C. Villiers, J.-P. Dognon, R. Pollet, P. Thuéry, M. Ephritikhine
Fabriquer du plastique sans pétrole et à partir du CO2 ? Des recettes sont connues depuis longtemps, mais les détails des processus réactionnels restaient encore mystérieux. Les chercheurs du SIS2M viennent d’identifier un composé intermédiaire dont la structure et la répartition des charges (zwitterion) permet d’expliquer la réaction entre une amine (guanidine) et le CO2, conduisant à la formation d’uréthane, qui par polymérisation conduit au polyuréthane, plastique souple remplaçant usuellement le caoutchouc.La fabrication du « plastique » est aujourd’hui essentiellement basée sur l’utilisation de dérivés du pétrole dont la consommation doit être maîtrisée. D’autres voies de synthèse en particulier par activation et transformation du dioxyde de carbone, matière première abondante et bon marché, existent depuis longtemps, mais leur principe reste mal connu. La compréhension de ces réactions de synthèse est donc restée un défi et devient une priorité majeure pour la communauté scientifique. La molécule de CO2 est réputée très stable, à la fois thermodynamiquement et cinétiquement, mais ses réactions avec les amines* primaires ou secondaires ont fait l’objet de nombreuses études, depuis la synthèse de l’urée ou la production industrielle de carbamates (composés R-HN-(C=O)O-R’), employés en grande échelle comme pesticides, jusqu’à l’utilisation de composés aminés pour le piégeage du CO2. Les amines peuvent également jouer le rôle de catalyseurs dans certaines réactions telles que la préparation de carbonates organiques (CO32-), substituts du phosgène dans la synthèse de polycarbonates (plastique dur) et polyuréthanes.
*amines : composés organiques dérivés de l’ammoniac NH3 (primaire, secondaire : substitution d’1 ou 2 H par un groupe carboné).

Toutes ces transformations sont supposées faire intervenir comme premier intermédiaire le composé d’addition entre le catalyseur amine et le dioxyde de carbone, R2NH-CO2. L’intervention d’un tel adduit est aussi évoquée en biologie dans l’interaction du CO2 avec les groupes NH2 des protéines. L’activation de la molécule de CO2 vis-à-vis de réactifs électrophiles proviendrait du transfert de charge au sein de cet adduit, conduisant à une structure zwitterionique avec la charge négative localisée sur le fragment CO2. Malgré leur ubiquité, de la science des matériaux à la biologie, aucun adduit de ce type n’a jamais pu être isolé et caractérisé : toutes les tentatives de synthèse n’ont conduit qu’à la formation du bicarbonate [R2NH2][HCO3] provenant de la réaction avec l’eau atmosphérique.
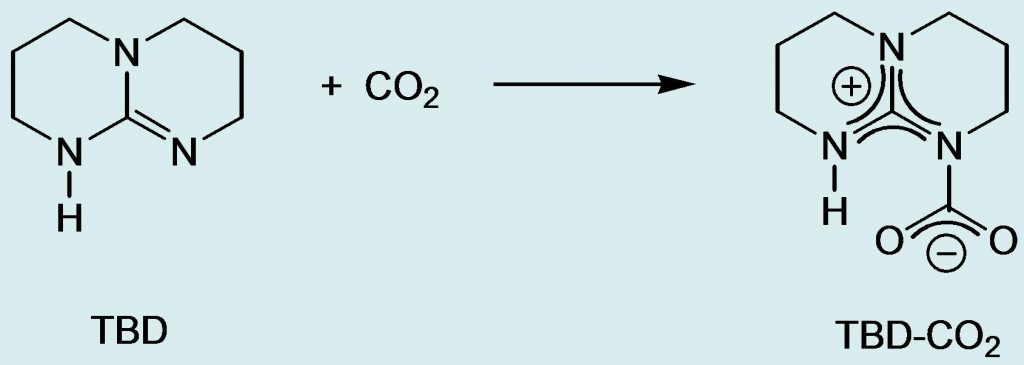
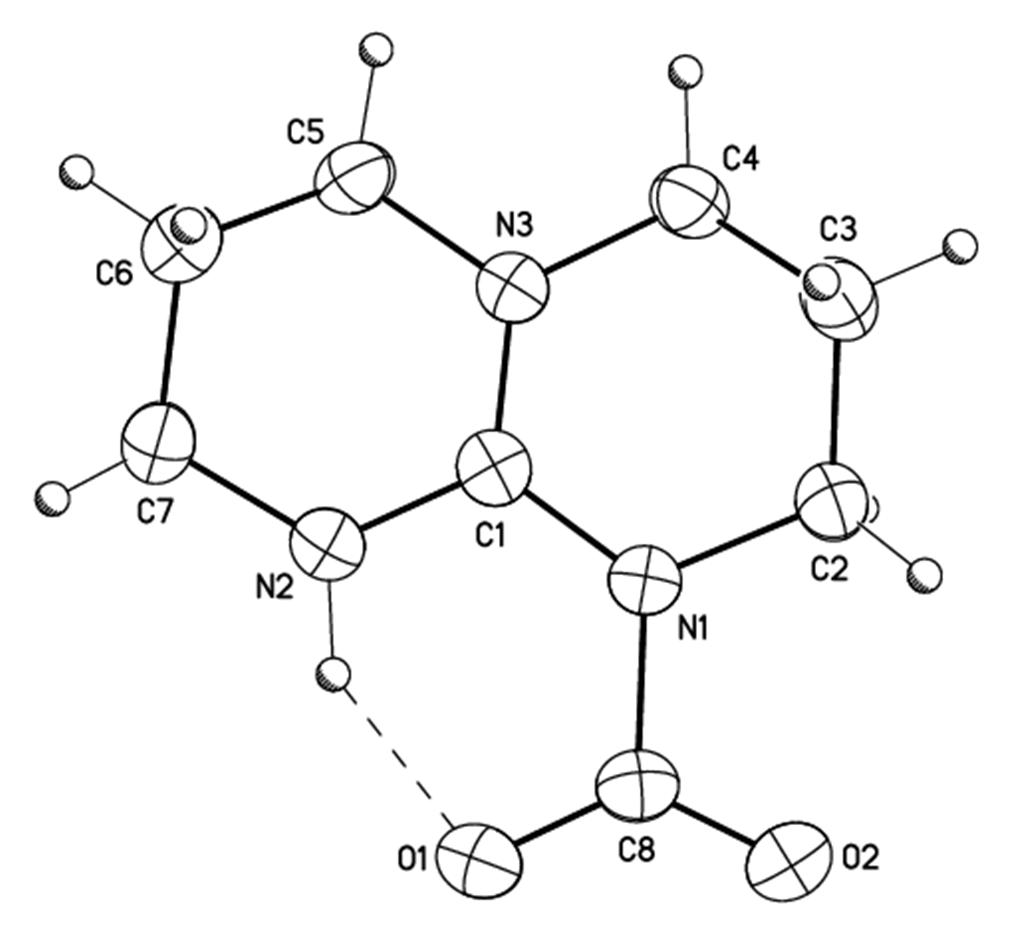
En travaillant dans des conditions strictement anhydres, nous avons obtenu des cristaux analytiquement purs de l’adduit TBD-CO2 entre la guanidine TBD (1,5,7-triazabicyclo[4,4,0]-dec-5-ène), représentée sur le schéma, et le dioxyde de carbone. Les guanidines sont couramment utilisées comme catalyseurs dans les réactions de CO2, leur plus grande efficacité par rapport aux amines simples étant expliquée par la formation d’un adduit stabilisé par délocalisation de la charge positive. La diffraction des rayons X sur monocristaux montre bien le caractère zwitterionique de cet adduit avec la présence du système cationique délocalisé de type guanidinium CN3+ et de la partie anionique de type carboxylate CO2– qui sont reliés par une liaison C-N longue de 1.480(3) Å (Figure 1). Cette distance est plus grande que celle mesurée dans les carbamates, typiquement égale à 1.35 Å. Les bandes d’absorption infrarouge correspondant à l’élongation des liaisons C-N et C-O apparaissent respectivement à 1605 et 1712 cm-1.
Les cristaux de TBD-CO2 sont stables sous atmosphère d’argon mais la perte de CO2 est observée à 40 °C sous vide primaire. L’adduit est très sensible aux traces d’eau, à l’état solide ou en solution, et se transforme immédiatement en le bicarbonate [TBDH][HCO3]. Les spectres de RMN du proton et du carbone révèlent que la molécule en solution est en équilibre avec TBD et CO2 ; en accord avec la structure de zwitterion, cette dissociation est beaucoup moins prononcée dans les solvants polaires tels que l’acétonitrile. Les spectres indiquent également que le proton sur l’atome d’azote et le groupe CO2 s’échangent rapidement à la température ambiante.
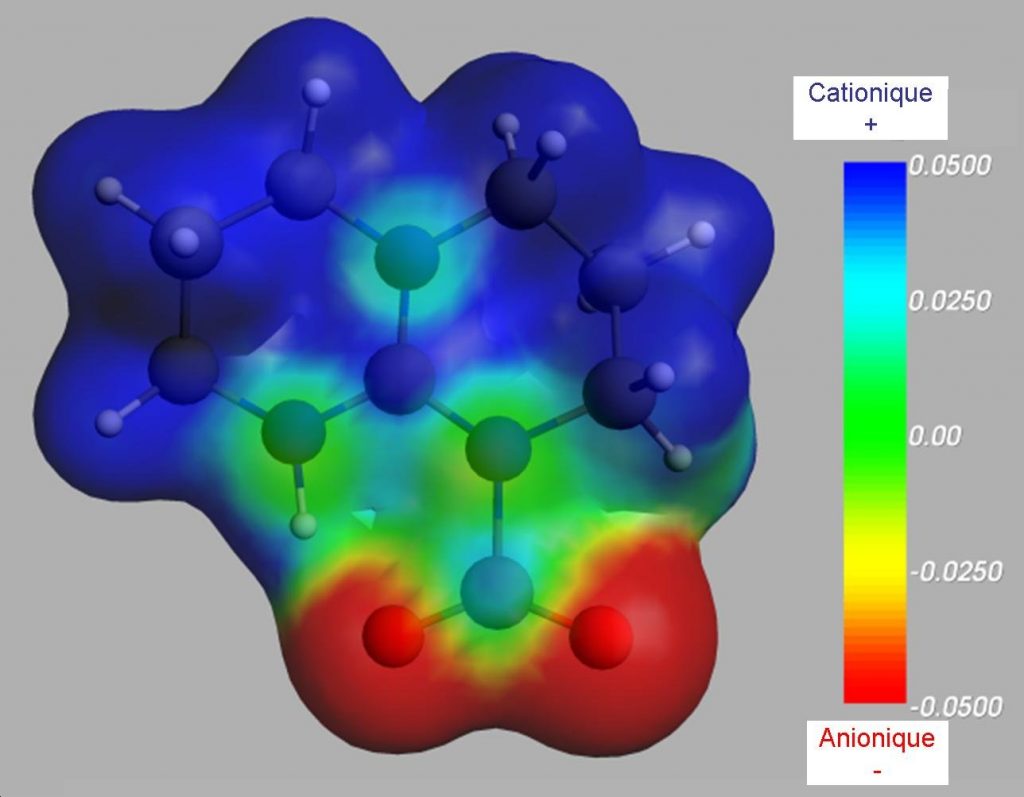
La simulation numérique (chimie quantique) a permis de confirmer le caractère zwitterionique de l’adduit TBD-CO2 et de visualiser la séparation de charge (Figure 2). Nous avons aussi montré qu’il était nécessaire d’inclure dans notre calcul les effets d’environnement, en particulier l’empilement induit par la formation d’un réseau de liaisons hydrogène à l’état solide, pour rendre compte de la structure observée expérimentalement. Une analyse détaillée montre que l’interaction est essentiellement régulée par les effets électrostatiques et de dispersion. Les simulations ont également permis de compléter l’interprétation des spectres d’absorption infrarouge mesurés.
Référence :
| The first isolated CO2 adduct of a nitrogen base: its crystal and electronic structures C. Villiers,* J.-P. Dognon,* R. Pollet, P. Thuéry and M. Ephritikhine Angewandte Chemie International Edition 49 (2010) 3465. |