J. Deschampsab, F. Audonnetac, N. Brodie-Linderad, M. Schoeffela et C. Alba-Simionescoac
Quelle est la plus basse température à laquelle l’eau peut rester liquide ?
La surfusion de l’eau est un phénomène bien connu et des records de température ont été atteint (~ 235 K = -40 °c) par cette voie. Un autre moyen pour maintenir de l’eau liquide à des températures négatives consiste à confiner le liquide dans une structure nanométrique de matériaux poreux. A cette échelle, du fait du volume limité, les effets de surface-interface deviennent importants et une température record de 206 K (pour un diamètre de pore de 2.3 nm) a pu être atteinte !
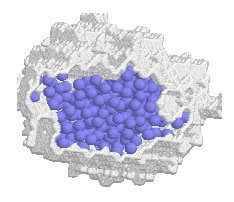
Cette situation d’eau confinée est d’autant plus importante à étudier qu’elle est relativement courante : en géologie, en chimie, en biologie (cellules, pores…) ou encore d’un point de vue technologique dans le développement de la nano-fluidique (filtrage-purification, biopuces, …).
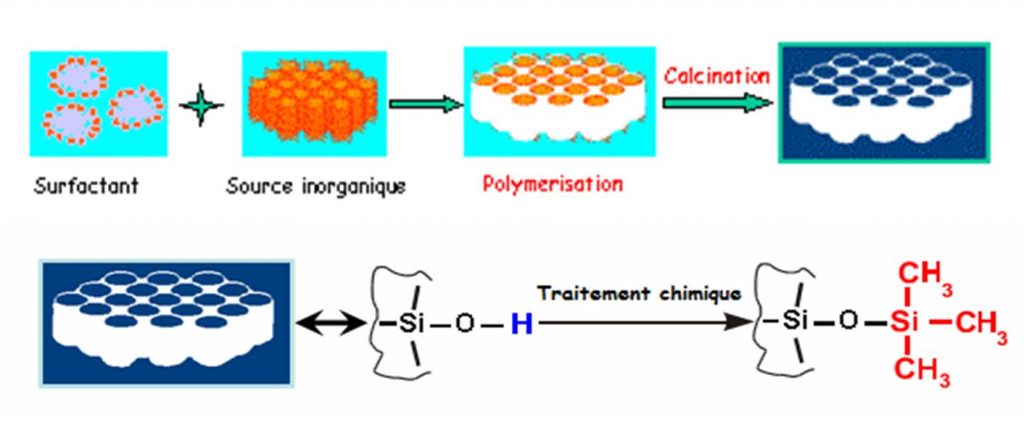
Pour cette étude un matériau nanoporeux, désigné sous le nom commercial de MCM-41[1], a été utilisé. Il présente un réseau en nid d’abeilles de nano-pores cylindriques non interconnectés, dont la taille des pores est modulable de 1.5 à 20 nm (soit quelques diamètres moléculaires de l’eau pour le matériau utilisé de 2.3 nm). Après synthèse, le matériau est naturellement hydrophile (présence de groupements Si-OH sur les parois). Un traitement chimique post-synthèse permet de le rendre hydrophobe (remplacement des -OH par des -O-Si(CH3)3). Le schéma de synthèse est représenté sur la figure ci-contre.
[1] MCM désigne une famille de matériaux mésoporeux, « Mobil Crystalline Material » synthétisés par les chercheurs de la Sté Mobil.
Les pores étant hydrophobes, l’eau ne peut y pénétrer spontanément et une pression suffisante (25 à 600 MPa pendant 90 min) doit être appliquée au liquide pour compenser l’énergie d’interface (phénomène d’intrusion). La pression du système est alors brutalement abaissée afin d’éviter l’extrusion de l’eau et le matériau hydraté obtenu est ensuite refroidit pour atteindre le point de solidification de l’eau sous la forme de glace ou amorphe. Par simple calorimétrie, il est ensuite possible, au cours d’un réchauffement très lent, de détecter la transition de liquéfaction, définie ici par le maximum du pic endothermique. En parallèle le système a aussi été caractérisé par diffusion élastique de neutrons au Laboratoire Léon Brillouin (LLB), permettant de bien caractériser le matériau et d’identifier les différentes phases, confirmant la présence d’eau liquide au sein du pore.
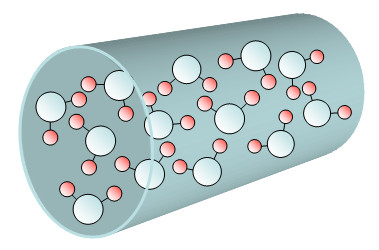
En faisant varier le diamètre des pores, il a été possible de définir que la température minimale à laquelle la cristallisation peut encore se produire est de 206 K, pour un diamètre de pores de 2.3 nm. Pour des diamètres inférieurs, l’eau se solidifie à une température supérieure mais sous une forme amorphe. Un matériau présentant une taille de pores similaire avec une texture hydrophile a été étudié pour comparaison et montre l’effet opposé, avec une plus grande difficulté à maintenir la surfusion.
Ceci montre que les effets de tension de surface sont à l’origine du phénomène. Sur un objet de taille nanométrique cette tension de surface se traduit par une variation de pression interne qui déplace donc le point de fusion. L’eau est particulière de ce point de vue : contrairement au comportement général, une augmentation de pression (comme celle induite par un accroissement de tension superficielle) tend à maintenir l’eau liquide[1]. Ainsi les canaux hydrophobes tendent, en imposant une pression positive, à maintenir l’eau liquide tandis que des pores hydrophiles, de faible tension d’interface avec l’eau favorisent la cristallisation en imposant une pression négative au liquide.
Cette expérience sur l’eau confinée, révélant la persistance d’un état liquide à la température record de 206 K, montre combien le monde nanométrique peut être différent de notre monde macroscopique. Ce résultat est certainement riche de fortes implications en nanofluidique, en géologie, pour la compréhension des systèmes biologiques ou encore dans l’étude des matériaux.
[1] Dans un diagramme pression-température, la limite solide-liquide de l’eau présente une pente négative en fonction de la température. Cette propriété est à associer au fait que la glace occupe un volume plus important que l’eau : une augmentation de pression tend alors à liquéfier
Référence :
« A thermodynamic limit of the melting/freezing processes of water under strongly hydrophobic nanoscopic confinement »,
J. Deschamps, F. Audonnet, N. Brodie-Linder, M. Schoeffel, C. Alba-Simionesco
Physical Chemistry Chemical Physics, 2010, 12, 1440.
a) Laboratoire de Chimie Physique, Université Paris Sud, Bât. 349, 91405 Orsay Cedex, France.
b) Ecole Nationale Supérieure de Techniques Avancées (ENSTA ParisTech), Unité Chimie et Procédés, 32 Boulevard Victor, 75739 Paris Cedex 15, France
c) Laboratoire Léon Brillouin, CEA Saclay, Bât. 563, 91191 Gif-sur-Yvette Cedex, France
d) Université Cergy Pontoise, Département de Chimie, 5 mail Gay Lussac, 95301 Cergy-Pontoise Cedex, France

