Le transport et la délivrance ciblée de principes actifs reposent largement sur l’utilisation de nano-vecteurs capables de circuler dans l’organisme sans être rapidement éliminés. L’un des défis majeurs consiste à concevoir des systèmes « furtifs », limitant l’adsorption des protéines et la formation d’une couronne protéique qui altère leur comportement biologique. La PEGylation constitue aujourd’hui la stratégie de référence pour répondre à cet enjeu.
Dans ce contexte, des chercheurs du Laboratoire Léon Brillouin (CEA-IRAMIS), en collaboration avec plusieurs partenaires français et européens, ont développé une approche simple et robuste permettant de concevoir des auto-assemblages PEGylés thermo-réversibles, dont la morphologie peut être contrôlée entre tubes, vésicules et micelles. Cette stratégie, fondée sur des acides gras biosourcés et une ingénierie fine de la courbure membranaire, ouvre de nouvelles perspectives pour la conception de nano-vecteurs adaptables aux conditions physiologiques.
En pharmacologie, le transport et la délivrance contrôlée de principes actifs reposent généralement sur leur encapsulation dans des nano-vecteurs de taille sub-micrométrique formés à partir de l’assemblage de tensioactifs (lipides, acides gras, etc.) et/ou de polymères. Un enjeu fondamental consiste à rendre ces nano-vecteurs « furtifs » afin d’empêcher l’adsorption des protéines présentes dans les fluides physiologiques, sans quoi une couronne protéique se forme rapidement autour des objets colloïdaux et gouverne leur comportement biologique in vivo. Pour ce faire, la stratégie la plus répandue consiste à décorer les nano-vecteurs d’une couronne de polymère protectrice composée de chaînes de polyéthylène-glycol (PEG).
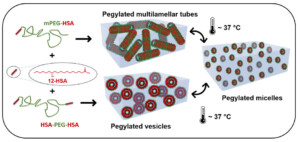
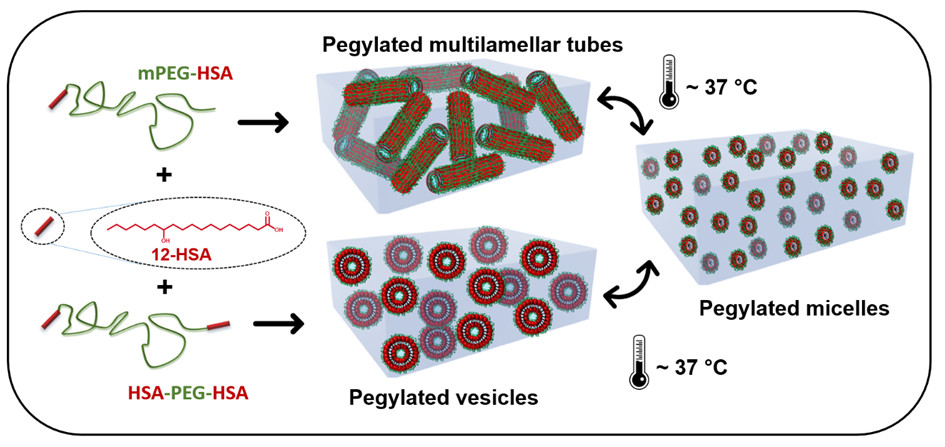
des chercheurs du Laboratoire Léon Brillouin**, en collaboration avec des partenaires en France et en Europe, ont développé une approche simple et robuste pour concevoir des auto-assemblages « PEGylés » présentant deux types de morphologies originales à température ambiante, respectivement des vésicules sphériques ou des tubes multi-lamellaires décorés de chaînes de PEG. Pour ce faire, ils ont combiné des molécules d’acides gras d’12-hydroxystéarique (12-HSA), un tensioactif issu d’agro-ressources – connu pour former spontanément des tubes en solution aqueuse – avec des chaînes de PEG fonctionnalisées par des groupements 12-HSA par une synthèse simple, soit à une seule extrémité de la chaîne, soit aux deux extrémités de la chaîne polymère.
Les chaînes mono-fonctionnalisées s’insèrent spontanément dans les tubes de 12-HSA alors que la forte modification de la courbure liée à l’insertion de chaînes di-fonctionnalisées dans les lamelles de 12-HSA induit la formation de vésicules. En outre, ces assemblages sont thermo-stimulables : ils transitent de manière réversible vers de petites micelles ellipsoïdales de quelques nanomètres de rayon et le choix judicieux des conditions physicochimiques a permis d’ajuster la température de transition à la température physiologique. Cette transition pilote les propriétés viscoélastiques des suspensions qui forment des gels mous à basse température et des liquides newtoniens à haute température.
La détermination fine des structures des assemblages a été réalisée par des mesures de diffusion de rayonnement des neutrons aux petits angles, une technique permettant la caractérisation structurale de suspensions sur des échelles spatiales variant de ~ 0.5 nm à 200 nm, et permettant d’accéder, via des techniques de marquage isotopique, à la structure spécifique de chacun des composants au sein des mélanges.
Référence
M. Almeida, D. Dudzinski, B. Couturaud, S. Prévost, V. Lutz-Bueno, N. Mahmoudi, C. Amiel, F. Cousin, C. Le Coeur, Design of thermo-responsive self-assembly of PEGylated fatty acids: Switching reversibly from tubes or vesicles to micelles at physiological temperature,
Journal of Colloid and Interface Science (Volume 693), 2025.
Collaboration
- Institut Chimie et des Matériaux Paris Est, Université Paris Est Créteil, CNRS, UMR 7182, 2 Rue Henri Dunant, 94320 Thiais, France.
- Institut Laue Langevin, 71 avenue des Martyrs, CS 20156, CEDEX 9, 38042 Grenoble, France.
- PSI Center for Neutron and Muon Sciences, 5232 Villigen PSI, Switzerland.
- ISIS Neutron and Muon Source, Rutherford Appleton Laboratory, Harwell Science and Innovation Campus, Chilton, Oxfordshire OX11 0QX, UK.
Contact CEA-IRAMIS
Fabrice Cousin – Laboratoire Léon Brillouin (LLB), CEA-IRAMIS.