Comprendre comment les électrons émis lors de la décharge d’une batterie interagissent avec l’électrolyte est indispensable pour mieux appréhender les causes de leur vieillissement. Les chercheurs du Laboratoire de chimie-physique (CNRS/Université Paris-Sud) et du laboratoire Nanosciences et innovation pour les matériaux la biomédecine et l'énergie (CNRS/CEA) ont utilisé la radiolyse impulsionnelle picoseconde pour étudier la formation des électrons solvatés et leur interaction avec les carbonates de l’électrolyte. Ils ont mis en évidence un comportement particulier dans le cas du carbonate de propylène cyclique par rapport aux espèces non cycliques (linéaires). Ces travaux font l’objet d’une publication dans le Journal of Physical Chemistry Letters.

Les carbonates organiques sont utilisés comme co-solvants dans les batteries lithium-ion. Grâce à leur forte polarité, ils peuvent dissoudre facilement les sels de lithium produits au cours de la décharge. Le problème de leur viscosité élevée est en général contourné en utilisant des mélanges de carbonates linéaires et cycliques. Une compréhension détaillée des phénomènes de vieillissement dans ces batteries passe par une étude fine du comportement de ces carbonates lorsque le courant est généré.
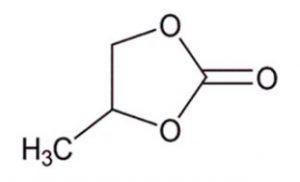
Les chercheurs se sont donc intéressés aux premières étapes de la réaction d’un électron en excès dans du carbonate de propylène (PC), composé cyclique fréquemment rencontré dans ces systèmes. Pour cela, ils ont utilisé la radiolyse impulsionnelle picoseconde, technique unique en Europe développée au laboratoire. Dans cette expérience, le faisceau d'électrons émis par la radiolyse provoque la formation d'espèces chimiques transitoires. En suivant l'évolution de ces espèces au cours du temps, on peut remonter aux différentes étapes de la réaction chimique menant à leur formation.
Grâce aux impulsions très courtes, il est possible de détecter des molécules dont la durée de vie est de l’ordre de quelques picosecondes.
Ces résultats montrent pour la première fois que les mécanismes de transfert d'électrons diffèrent fortement dans ce carbonate cyclique par rapport aux carbonates linéaires pour lesquels aucun radical anion n’est observé. Il reste maintenant à comprendre le rôle joué par la formation de ces radicaux dans le vieillissement de la batterie.

Référence :
Ultrafast decay of the solvated electron in a neat polar solvent: the unusual case of propylene carbonate,
S. Le Caër, D. Ortiz, J.-L. Marignier, U. Schmidhammer, J. Belloni & M.Mostafavi, Journal of Physical Chemistry Letters 7 (2016) 186
- Contact CEA-IRAMIS : Sophie le Caer (NIMBE/LIONS)
- Laboratoire de Chimie Physique (LCP) – Orsay : Mehran Mostafavi.
Collaboration :
- † IRAMIS/NIMBE/LIONS UMR 3685, CEA, CNRS, Université Paris-Saclay, Bât. 546, F-91191 Gif-sur-Yvette Cedex, France
- ‡ Laboratoire de Chimie-Physique/ELYSE, UMR 8000 CNRS, Université Paris Sud, Université Paris-Saclay, Bât. 349, F-91405 Orsay Cedex, France