La recherche de biomarqueurs volatils en vue d’un diagnostic non-invasif de pathologies telles que le cancer ou de maladies infectieuses comme la tuberculose, est un enjeu médical majeur. Dans le cadre du projet COVADIS, l’équipe Capteurs Chimiques d’IRAMIS/NIMBE/LEDNA, en collaboration avec BioMérieux et IRAMIS/LYDIL, a exploré la possibilité de détecter un marqueur spécifique de la tuberculose active, l’acide nicotinique, présent chez les patients infectés par Mycobacterium tuberculosis. Le défi est de trouver une méthode d’analyse simple et peu coûteuse pouvant rivaliser avec la méthode d’amplification de l’ADN recommandée par l’Organisation Mondiale de la Santé, mais qui reste chère pour les pays pauvres malgré un coût négocié.
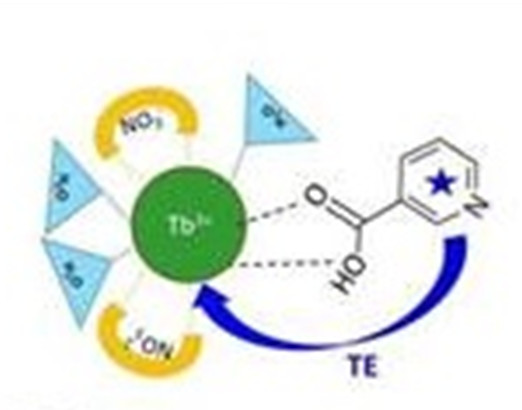
La molécule-sonde choisie est un sel de lanthanide, le nitrate de terbium, Tb(NO3)3, dont la luminescence dans le domaine visible est exaltée en présence d’acide nicotinique. Ce dernier forme avec le sel de terbium un complexe stable et joue le rôle d’antenne pour absorber efficacement les photons d’excitation et transférer l’énergie d’excitation vers l’ion lanthanide qui luminesce intensément. Pour s’affranchir de l’interférence des autres métabolites présents dans le condensat d’haleine, qui diminue l’intensité de luminescence, les chercheurs exploitent la différence de volatilité entre ces interférents et l’acide nicotinique. Le piégeage des composés volatils par des éponges nanoporeuses permet de recouvrer la luminescence intense des complexes de terbium signalant la présence d’acide nicotinique.
La simplicité de la méthode et son coût modique, comparé à la méthode d’amplification de l’ADN, fait de la détection de métabolites volatils une voie particulièrement prometteuse pour le diagnostic non-invasif de la tuberculose.
La tuberculose tue environ 2 millions de personnes chaque année, principalement à cause d’un diagnostic tardif ou inefficace ou de soins trop tardifs. Les techniques de diagnostic les plus efficaces sont souvent coûteuses et complexes à mettre en oeuvre dans les pays en voie de développement, régions de plus forte incidence de la maladie. L’objectif du projet COVADIS est d’explorer la possibilité de mettre en œuvre une méthode de détection simple et non invasive de Mycobacterium tuberculosis. La voie choisie est la détection d’un marqueur spécifique de la tuberculose active, l’acide nicotinique, présent à la fois dans les cultures de crachats et dans l’haleine expirée des patients infectés par la bactérie [1]. Le défi est de trouver une méthode simple d’analyse peu coûteuse qui pourrait rivaliser avec la méthode moléculaire d’amplification de l’ADN recommandée par l’Organisation Mondiale de la Santé [2], qui reste onéreuse pour les pays pauvres malgré un coût négocié.
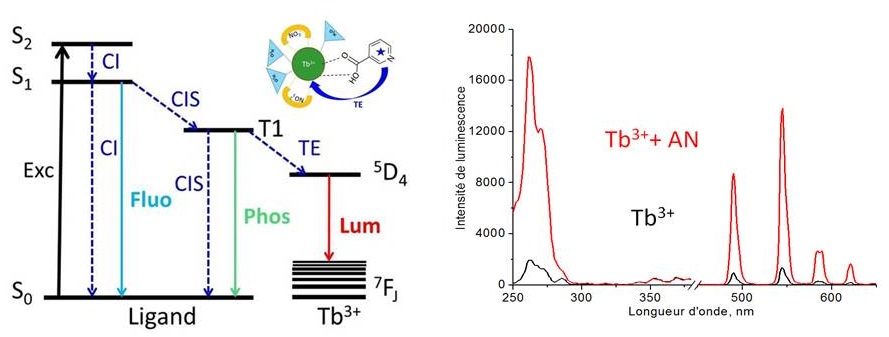
La stratégie choisie par les chercheurs d’IRAMIS/NIMBE/LEDNA, en collaboration avec BioMérieux et IRAMIS/LYDIL, est la détection de métabolites spécifiques émis par Mycobacterium tuberculosis. Il s’agit de pouvoir détecter de faibles teneurs d’acide nicotinique (nanomoles) dans le condensat d’haleine, la salive, l’urine, et de le discriminer vis-à-vis d’autres métabolites également présents dans ces fluides biologiques. Un complexe de nitrate de terbium (III) a été choisi comme molécule-sonde car la luminescence du terbium (III) peut être exaltée en présence de certains ligands organiques, notamment l’acide nicotinique [3]. Ce phénomène est lié au processus de transfert de l’énergie d’excitation de l’acide nicotinique excité à 260 nm vers un niveau plus bas en énergie de l’ion Tb3+ à partir duquel est émise la luminescence entre 480 et 630 nm.
Les premiers essais de détection de l’acide nicotinique dans la salive et l’urine ont montré des interférences importantes. Ces dernières sont dues à la formation de complexes non luminescents entre Tb3+ et les composés présents dans ces fluides biologiques, au détriment des complexes luminescents avec l’acide nicotinique. Cette interférence est bien moindre avec le condensat d’haleine composé de molécules volatiles et d’eau.
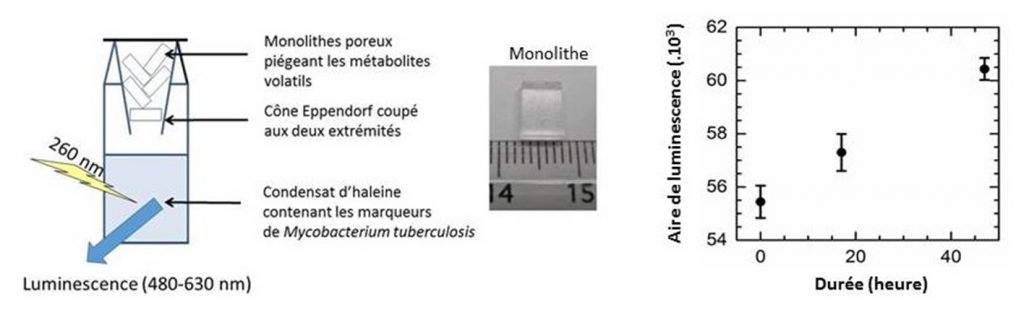
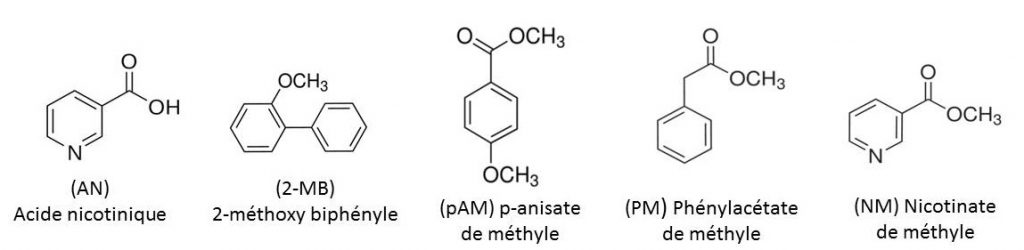
Ce constat a amené les chercheurs à déployer une nouvelle stratégie qui exploite la différence de volatilité entre l’acide nicotinique et les métabolites potentiellement interférents comme le nicotinate de méthyle (NM), le para-anisate de méthyle (p-AM), le phénylacétate de méthyle (PAM) et l’ortho-méthoxy biphényle (2-MB). La méthode consiste à piéger à l’aide de matériaux nanoporeux ces interférents qui sont 900 à 480 000 fois plus volatils que l’acide nicotinique et à détecter ce dernier en solution.
Une preuve de concept a été réalisée en utilisant des capteurs nanoporeux synthétisés via le procédé sol-gel par l’équipe Capteurs Chimiques [4]. Les capteurs sont placés au-dessus d’un milieu liquide contenant les réactifs (Tb(NO3)3 et acide nicotinique) et le nicotinate de méthyle, composé le moins volatils parmi les métabolites étudiés. Ces matériaux, véritables éponges nanoporeuses, «pompent» et piègent efficacement le nicotinate de méthyle permettant ainsi de recouvrer la luminescence intense des complexes de terbium avec l’acide nicotinique.
La détection de métabolites volatils, par sa simplicité et son coût de mise en œuvre, apparaît comme une voie particulièrement prometteuse pour le diagnostic non-invasif de la tuberculose. Son coût a été évalué et comparé à la méthode d’amplification de l’ADN recommandée par l’Organisation Mondiale de la Santé. Le prix réel de l’appareil XPERT MTB/Rif commercialisé par la société CEPHEID avec 4 cartouches est de 78200 $, le coût de chaque cartouche étant de 71,63 $. Le prix correspondant, négocié pour les pays en voie de développement, est de 16000 $ pour l’appareil et 9,98$ pour la cartouche. Le prix d’une analyse de crachat pour les USA est de 2673 $ et de 30 $ pour les pays pauvres. Ces prix ne tiennent pas compte des frais d’installation et de calibration annuelle qui varient d’un pays à un autre.
Pour la détection optique envisagée, le coût d’un phosphorimètre qui inclut une caméra CCD refroidie, un filtre optique à bande étroite, une fibre optique et une diode électroluminescente est estimé à 20000 € (non négocié). A ce prix se rajoutent un sac en plastique muni d’une cuvette optique pour recueillir l’haleine des patients et contenant une dizaine d’éponges nanoporeuses pour piéger les interférents volatils. Pour les pays pauvres, des réactions chimiques endothermiques peu coûteuses peuvent être mises à profit pour refroidir les vapeurs et obtenir un condensat d’haleine. L’ensemble de ces consommables est estimé à 105 € (prix non négocié).
Références :
[1] “The scent of Mycobacterium tuberculosis”, M. Syhre, S.T. Chambers,
Tuberculosis 88, 317-323 (2008).
[2] “Automated real-time nucleic acid amplification technology for rapid and simultaneous detection of tuberculosis and drug resistant tuberculosis: policy statement”,
WHO, Geneva, Switzerland, (2011) WHO/HTM/TB/2011.
[3] “Correlation between the lowest triplet state energy level of the ligand and lanthanide(III) luminescence quantum yield”,
M. Latva, H. Takalob, V.-M. Mukkalaa, C. Matachescuc, J.C. Rodríguez-Ubisd, J. Kankarea, Journal of Luminescence, 75(2) 149-169 (1997).
[4] « Capteurs chimiques à base de matrices nanoporeuses pour la détection de métabolites volatils de la tuberculose »,
W. Bamogo, Thèse de l’Université de Paris-Sud, NNT 2015 PA112010.
« Assessment of terbium (III) as a luminescent probe for the detection of tuberculosis biomarkers »
W. Bamogo, L. Mugherli, A. Banyasz, A. Novelli-Rousseau, F. Mallard, T.-H. Tran-Thi, Analytica Chimica Acta, 896 (2015) 143.
Projet « Fonds Unique Interministériel-FUI » 2010 COVADIS, porté par Ethera.
Contact CEA-IRAMIS : Thu-Hoa TRAN-THI (NIMBE/LEDNA-Equipe CAPTEURS CHIMIQUES)
Collaboration :
- Akos BANYASZ, IRAMIS/LIDYL/DICO
- Armelle NOVELLI-ROUSSEAU et Frédéric MALLARD, BioMérieux Grenoble.





