J.-P Dognon, C Clavaguéra, and P. Pyykko
C Clavaguéra : Laboratoire des Mécanismes Reactionnels, Ecole Polytechnique, CNRS, 91128 Palaiseau (France)
P. Pyykko : Department of Chemistry, University of Helsinki, Finland
La compréhension des propriétés de liaison d’une molécule est fortement liée à son nombre d’électrons de valence. La règle des 18 électrons, très utilisée dans la chimie des métaux de transition permet de prévoir la stabilité des complexes métalliques. Elle stipule que « le métal tend à accepter, de la part des ligands qui l’entourent, le nombre d’électrons nécessaires pour compléter sa couche de valence à un nombre optimal d’électrons de 18 ». Il acquiert alors la configuration électronique du gaz rare qui le suit dans la classification périodique, à savoir (n-1)d10ns2np6. Est-il possible d’aller au-delà dans la classification périodique, c’est à dire d’établir une règle semblable pour les éléments f (lanthanides et actinides) susceptibles d’apporter 14 électrons supplémentaires soit au total une règle à 32 électrons ?
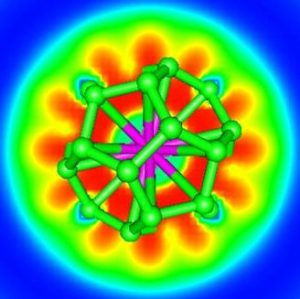
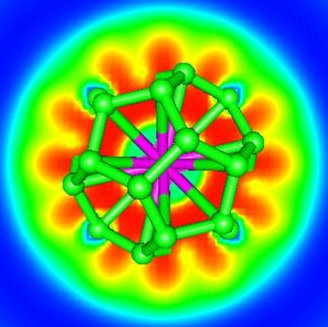
La réponse est oui ! Des chimistes théoriciens du CEA (Saclay), du CNRS (Ecole Polytechnique, Palaiseau) et de l’université d’Helsinki (Finlande) ont proposé pour la première fois un système à 32 électrons : An@Pb12 (An=Pu, Am+) grâce à la simulation numérique (chimie quantique). Celui-ci est constitué d’une cage de plomb encapsulant un actinide. Plus récemment, ces mêmes chercheurs ont généralisé ce principe en proposant une nouvelle famille de composés An@C28. Une étude en chimie quantique a montré que de tels complexes pouvaient être particulièrement stables et à 32 électrons. La théorie de la fonctionnelle de la densité a été utilisée pour étudier Th@C28, Pa+@C28, U2+@C28 et Pu4+@C28. Ces complexes ont une symétrie tétraédrique avec 16 « liaisons » entre la cage C28 et le métal. Les calculs montrent que les orbitales 7s, 7p, 6d et 5f de l’élément f central s’hybrident avec celles de la cage pour former un système à 32 électrons. Les propriétés thermodynamiques calculées révèlent que les complexes peuvent se former spontanément en phase gazeuse. C’est ce qui a été mis en évidence dans la littérature pour U@C28, seul composé caractérisé expérimentalement à ce jour. Les agrégats contenant des lanthanides, bien que stables, ne satisfont pas à la règle des 32 électrons énoncée.
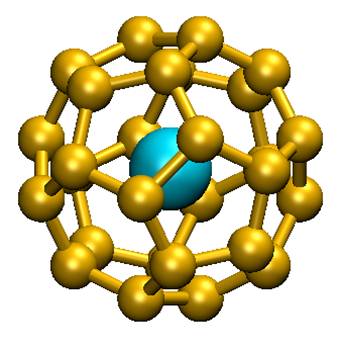
Ces agrégats éléments f – carbone constituent de nouveaux composés pouvant servir de briques élémentaires d’assemblage de nanomatériaux à propriétés électroniques, magnétiques, optiques ou chimiques contrôlables. L’existence de cette nouvelle classe d’agrégats endohédriques atomiques a permis de transformer une curiosité scientifique (An@Pb12) en l’énoncé d’un nouveau principe à 32 électrons.
Ces travaux ont fait l’objet de deux publications dans Angew. Chem. Int. Ed. et J. Am. Chem. Soc. et choisis par l’American Chemical Society pour une « news » dans Chemical & Engineering News.
Pour en savoir plus :
|
|
A predicted organometallic series following a 32-electron principle: An@C28 (An = Th, Pa+, U2+, Pu4+) J.-P Dognon, C Clavaguéra, and P. Pyykkö, J. Am. Chem. Soc. 131 (2009) 238. |
|
|
Voir aussi : l'article « Stable Caged Actinides Proposed » by Jyllian N. Kemsley, Chemical & Engineering News, December 15, 86(50) (2008) 29. |
|
Towards a 32-electron principle: Pu@Pb12 and related systems J.-P Dognon, C Clavaguéra, and P. Pyykkö, Angew. Chem.-Int. Edit. 46 (2007) 1427. |
Voir aussi le fait marquant 2012 : 32 électrons : d'une règle à un principe chimique !