La formation de méthanol (CH3OH) à partir du CO2 est une stratégie prometteuse pour la production d’un carburant à haute densité énergétique, à partir de ressources renouvelables et d’énergie décarbonée. Cependant les catalyseurs existant pour l’électrolyse directe du CO2 en méthanol ne sont ni efficaces, ni sélectifs et l’hydrogénation du CO2 pose des problèmes d’industrialisation liés à l’utilisation de hautes pressions.
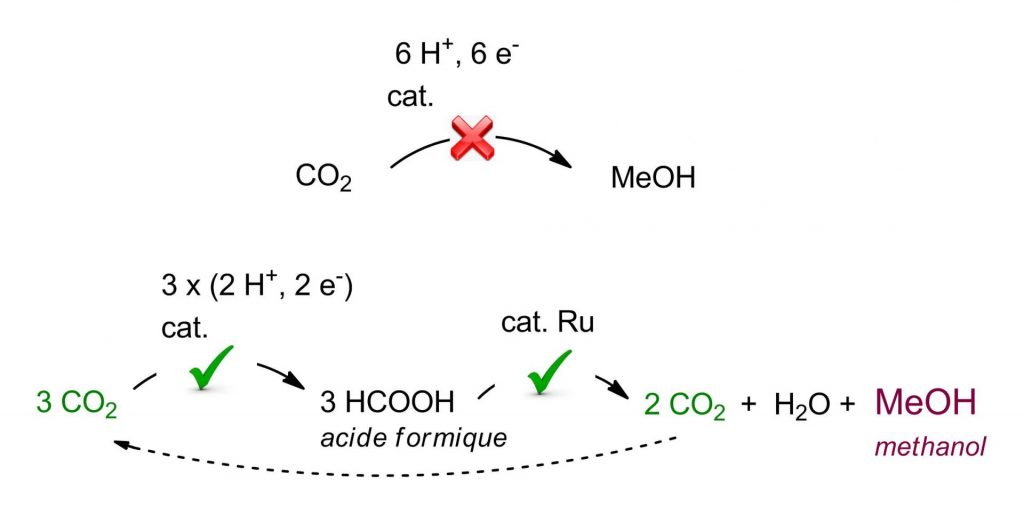
L’électro–réduction du CO2 en acide formique est en revanche facile car elle conduit à la formation d’une seule liaison C–H contre trois pour le méthanol. Une alternative intéressante pour convertir le CO2 en méthanol serait donc d’utiliser l’acide formique comme relai, à condition d’être capable de convertir ensuite efficacement celui-ci en méthanol. Alors que cette dernière réaction est actuellement effectuée avec des rendements inférieurs à 2%, en présence de catalyseur à base d’iridium, le LCMCE (Laboratoire de Chimie Moléculaire et Catalyse pour l’Énergie) a récemment développé une catalyse efficace au ruthénium avec des rendements atteignant 50% en méthanol.
Alors que les ressources carbonées fossiles, telles que le pétrole, le gaz et le charbon, couvrent plus de 85% de la demande énergétique mondiale, la recherche de nouveaux carburants, présentant un bilan carbone nul, focalise de nombreux efforts. Dans ce nouveau modèle énergétique, le carburant idéal possède une forte densité d’énergie et est formé à partir de ressources et énergies renouvelables. Le méthanol (CH3OH), utilisable dans les piles à combustible ou les moteurs à combustion, pourrait être un tel candidat. Il peut en effet être formé à partir de la réduction à 6-électrons d’une matière carbonée renouvelable, le CO2. Pourtant, à l’heure actuelle, aucun catalyseur ne permet de réaliser efficacement la réduction sélective du CO2 en méthanol dans un réacteur d’électrolyse. L’hydrogénation du CO2 est, quant à elle, déjà développée avec des catalyseurs au ruthénium [1], mais elle souffre encore de l’utilisation de l’hydrogène à haute pression.
La réduction à 2-électrons du CO2 vers l’acide formique (H-COOH) est, elle, efficace et bien maitrisée [2] L’acide formique pourrait donc jouer le rôle de relai pour la production de méthanol à partir de ressources renouvelables, à condition que le méthanol soit efficacement produit à partir de l’acide formique.
La formation de méthanol à partir de l’acide formique a été observée (indirectement) pour la première fois en 1911 par Paul Sabatier, prix Nobel de chimie français. Mais il a fallu attendre 2013, pour que les premiers catalyseurs permettant la conversion de l’acide formique en méthanol voient le jour, avec les travaux du groupe de K. Goldberg à l’université de Washington [3]. Cette avancée repose néanmoins sur l’utilisation d’un métal rare, l’iridium, et ne permet d’obtenir le méthanol qu’avec un rendement maximum de 2 %. Pour obtenir une approche globale efficace dans l’utilisation du CO2 comme vecteur d’énergie, une meilleure efficacité est donc nécessaire.
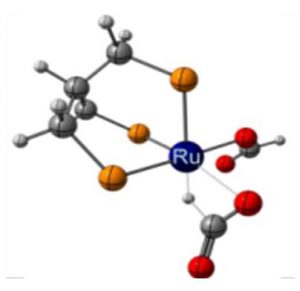
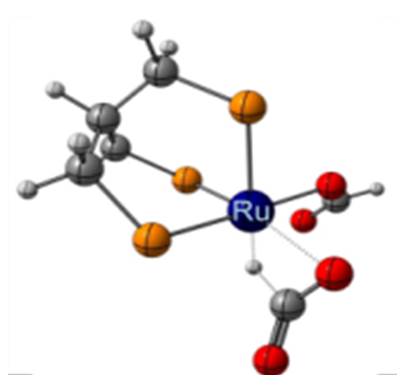
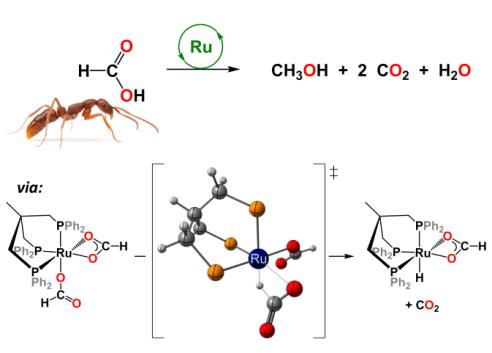
Une catalyse au ruthénium permettant d’obtenir le méthanol à partir de l’acide formique avec un rendement de 50% a donc été développée au LCMCE. L’utilisation du ruthénium au lieu de l’iridium présente un avantage économique certain, ce métal étant plus de dix fois moins couteux que l’iridium. Le mécanisme de la réaction a également été étudié par une approche duale expérimentale et théorique qui a permis de mettre en avant les intermédiaires et les espèces catalytiques mis en jeu dans la formation du méthanol. Il a été ainsi montré que l’espèce active en catalyse était un complexe hydrure de ruthénium permettant de redistribuer efficacement la liaison C-H de l’acide formique. Cette réaction permet donc de former du méthanol et deux molécules de CO2 à partir de trois molécules d’acide formique [4].
[1] a) P. G. Jessop, T. Ikariya, R. Noyori, Chem. Rev. 1995, 95, 259; b) S. Wesselbaum, T. vom Stein, J. Klankermayer, W. Leitner, Angew. Chem. Int. Ed. 2012, 51, 7499; Angew. Chem., 2012, 124, 7617.
[2] Pour une revue voir : H.-R. Jhong, S. Ma, P. J. A. Kenis, Current Opinion in Chemical Engineering, 2013, 2, 191.
[3] A. J. M. Miller, D. M. Heinekey, J. M. Mayer, K. I. Goldberg, Angew. Chem. Int. Ed., 2013, 52, 3981; Angew. Chem., 2013, 125, 4073.
[4] Efficient disproportionation of formic acid to methanol using molecular ruthenium catalysts
S. Savourey, G. Lefèvre, J.C. Berthet, P. Thuéry, C. Genre, T. Cantat, Angew. Chem. Int. Ed., 53(39) (2014) 10466.

Communiqué de presse du CEA : » Produire du méthanol à partir de CO2 en passant par l’acide formique« .
Contact CEA-IRAMIS : Thibault Cantat (NIMBE/LCMCE – Laboratoire de Chimie Moléculaire et Catalyse pour l’Énergie).