Les nanomédicaments sont considérés comme des thérapies prometteuses pour le traitement du cancer. Cependant, leur utilisation clinique reste encore limitée, dû en partie au fait que leur comportement biologique n'est pas encore vraiment élucidé. Extraire des théories générales à partir de la grande variété de nanoparticules et des conditions de leur utilisation reste en effet difficile, et les techniques pertinentes font défaut pour obtenir des informations in situ.
Dans ce travail, ces deux aspects du problème sont abordés en combinant des nanoparticules modèles de nature variable avec des outils in situ basés sur des techniques de diffusion de aux petits angles (SAS, rayons X ou neutrons). La stratégie repose sur le développement d’une bibliothèque de nanoparticules greffées de polymères avec des cœurs d’or identiques, afin de réaliser une étude systématique de leurs interactions avec les systèmes biologiques. Il est ainsi montré qu'une modulation de la chimie des polymères modifie les propriétés de surface, tout en conservant la même structure des nanoparticules, ce qui permet une comparaison fiable entre les objets.
Quatre aspects spécifiques ont été plus particulièrement examinés: la stabilité colloïdale, la captation cellulaire, la toxicité et la diffusion dans la matrice extracellulaire. De manière intéressante, il a été montré que la copolymérisation entre les monomères hydrophobes et chargés positivement contribue à réduire significativement la toxicité des nano-objets tout en conservant une bonne internalisation cellulaire. Les techniques SAS ont ainsi fourni des informations précieuses in situ sur l'évolution et la migration des nanoparticules dans des environnements biologiquement pertinents (milieux de culture cellulaire et matrice extracellulaire). [1, 2, 3]
La nanomédecine, application des nanosciences à la médecine, offre de nouvelles voies thérapeutiques prometteuses, en particulier pour le traitement du cancer. En particulier, les nanoparticules métalliques fonctionnalisées présentent un intérêt dans le domaine de la radiothérapie comme agent radiosensibilisant [4] et peuvent également servir à la vectorisation de médicaments [2, 3]. Cependant, leur application clinique reste encore limitée dû au manque de maitrise du comportement des nanoparticules en milieu biologique. Une autre difficulté est la nécessité de disposer des techniques pertinentes pour obtenir des informations in situ sur les nano-objets considérés.
L'étude menée par une équipe du NIMBE, en collaboration avec le LLB, apporte des éléments de réponse à cette problématique très générale, en étudiant le comportement de nanoparticules modèles de natures diverses, au moyen d'outils in situ basés sur les techniques de diffusion de rayons X ou de neutrons aux petits angles (SAXS et SANS). La stratégie de recherche consiste à développer une bibliothèque de nanoparticules d'or greffées de polymères de nature variable et à étudier systématiquement leurs interactions avec les systèmes biologiques.
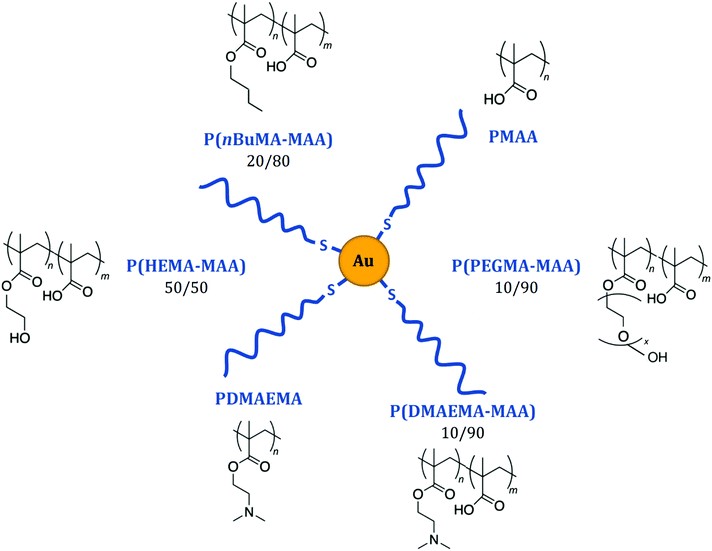
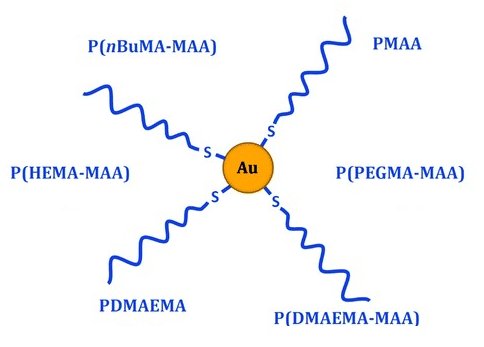
Nanoparticules d'or avec les différentes couronnes de polymères et copolymères de polyméthacrylate étudiées (sous chaque copolymère, les chiffres indiquent les proportions théoriques de chaque unité monomère).
Les nanoparticules d'or greffées possèdent plusieurs propriétés intéressantes qui ont déjà été exploitées pour le traitement du cancer : elles sont sont radiosensibilisantes c’est-à-dire capable d’augmenter localement l’effet d’une irradiation, biocompatibles et peuvent être aisément produites et fonctionnalisées [2,3]. Des nanoparticules d'or greffées de polymères « méthacrylate » (CH2=C(CH3)COO−) ont ainsi été synthétisées et choisies comme modèles. Il est en effet possible de moduler la nature chimique des polymères afin de modifier les propriétés de surface de l'ensemble, tout en conservant la même structure de base pour toutes les nanoparticules. Cette unité structurale permet une comparaison fiable des différents types de nanoparticules fonctionnalisées pour en extraire des principes généraux. La polyvalence de la méthode de synthèse a aussi permis d'affiner les propriétés de surface des nanoparticules, notamment par copolymérisation, et d'optimiser ainsi leur comportement biologique.
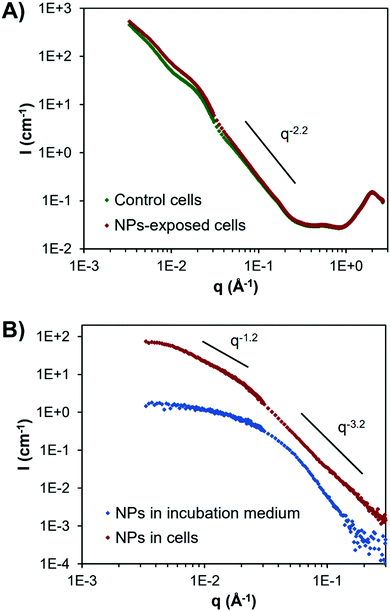
Quatre aspects spécifiques ont été plus particulièrement examinés : la stabilité colloïdale (éviter l'aggrégation des nanoparticules), la diffusion cellulaire, la diffusion extra-cellulaire et la toxicité. Le SAXS in situ fourni ainsi des informations précieuses sur l'évolution de la dispersion des nanoparticules dans des environnements biologiquement pertinents. Une bonne stabilité colloïdale des nanoparticules synthétisées est ainsi démontrée dans les milieux de culture cellulaire, tandis que la quantité de nanoparticules internalisées et leur pénétration intracellulaire peuvent aussi être évaluées via cette technique.
Dans cette étude, les charges positives et l'hydrophobicité de la couronne polymère sont plus particulièrement identifiées comme des paramètres clés influençant la toxicité et l'internalisation au sein des cellules cibles. À l’opposé, des charges négatives favorisent la diffusion dans la matrice extracellulaire. Il est notamment intéressant de noter que la copolymérisation entre les monomères hydrophobes et à charge positive contribue à réduire de manière significative la toxicité de l'ensemble, tout en conservant la capacité d’une meilleure internalisation.
Ces résultats montrent tout le potentiel de ces techniques de synthèses et de caractérisation, en particulier la diffusion de rayons X aux petits angles, pour la nanomédecine.
Références :
[1] « Combining surface chemistry modification and in situ small-angle scattering characterization to understand and optimize the biological behavior of nanomedicines »,
M. Le Goas, T. Roussel, M. Kalbazova D. Carrière, E. Barruet, V. Geertsen, G. C. Fadda, F. Testard, G. Carrot and J.-P. Renault, Journal of Materials Chemistry B (2020).
[2] “Irradiation effects on polymer-grafted gold nanoparticles for cancer therapy”
M. Le Goas, A. Paquirissamy, D. Gargouri, G. Fadda, F. Testard, C. Aymes-Chodur, E. Jubeli, T. Pourcher, B. Cambien, S. Palacin, J.-P. Renault and G. Carrot, ACS Appl. Bio Mater. 2019, 2, 1, 144–154.
[3] “How do surface properties of nanoparticles influence their diffusion in the extracellular matrix? A model study in Matrigel using polymer-grafted nanoparticles » M. Le Goas, Marine; F; Testard; O. Taché; N. Debou; B. Cambien; G. Carrot; JP Renault, Langmuir, sous presse.
[4] “Improving 131I radioiodine therapy by hybrid polymer-grafted gold nanoparticles”
M. Le Goas, M. Paquet, A. Paquirissamy, J. Guglielmi, C. Compin, J. Thariat, G. Vassaux, V. Geertsen, O. Humbert, J.-P. Renault, G. Carrot, T. Pourcher, B. Cambien, Int. J. Nanomedicine 2019, 14, 7933–7946.
Contacts CEA : Geraldine Carrot (NIMBE/LICSEN) et Jean-Philippe Renault (NIMBE/LIONS) du NIMBE, UMR 3685 CEA-CNRS.