Collaboration CEA-DSV/LCBM – CEA-LITEN – CEA-LETI et CEA-IRAMIS
Dans le cadre du développement de la filière énergétique hydrogène, la production d'hydrogène par électrolyse de l'eau nécessite des catalyseurs efficaces. En remplacement du platine, rare et cher, des oxydes de cobalt ont été proposés. Par un traitement électrochimique simple, des catalyseurs à base de cobalt bon marché, efficaces et réversibles (capable de catalyser à la fois les réactions d'oxydation à l'anode et de réduction à la cathode) ont été obtenus.
Qu’il s’agisse de produire du dihydrogène à partir de l’eau (une voie envisagée pour stocker une énergie électrique intermittente) ou de le reconvertir en l’électricité (dans une pile à combustible), il est difficile de s’affranchir du platine, de loin le meilleur catalyseur pour rendre ces réactions efficaces. Ce champion de la catalyse est pourtant le talon d’Achille d’une éventuelle « économie de l’hydrogène », car il est rare (pas plus de 5 µg/kg dans la croûte terrestre) et donc très cher. Il est ainsi impératif de réduire la quantité utilisée (nanoparticules, films ultraminces..), ou d'essayer de le remplacer par des alliages, d’autres métaux nobles, et surtout par des métaux abondants. La nature est pour cela une source essentielle d’inspiration, puisqu’elle sait décomposer l’eau en hydrogène et oxygène (par une réaction d'oxydation de l'eau) à partir de composés du fer, du nickel, ou du manganèse, tous métaux de la première série de transition et abondants.
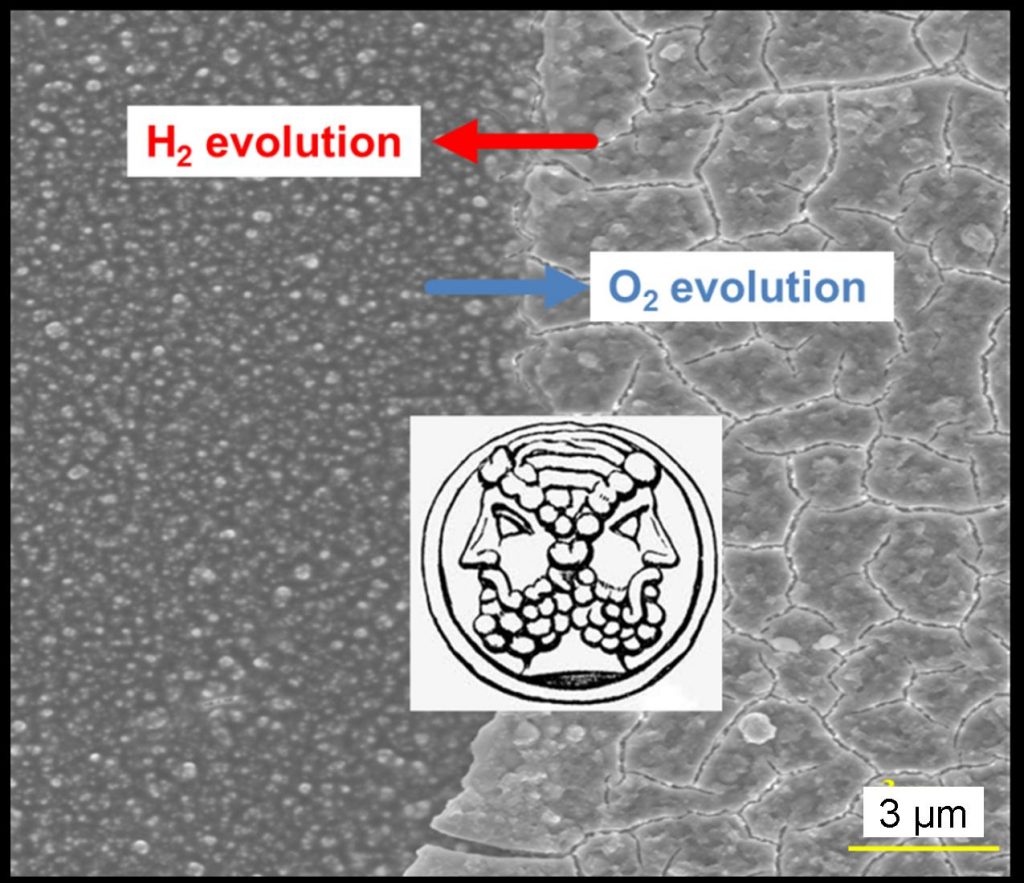
Dans ces systèmes naturels, le cobalt n’est généralement présent que comme cofacteur (comme dans la vitamine B12, par exemple). Les travaux pionniers de Daniel G. Nocera du Département of Chemistry du MIT ont pourtant montré que certains oxydes de cobalt sont eux-mêmes d’excellents catalyseurs d’oxydation de l’eau. Deux équipes du CEA (DSV/IRTSV/LCBM et IRAMIS/SPCSI/LCSI) ont récemment fait mieux en développant un matériau capable, au prix d’un traitement électrochimique simple, de servir de catalyseur réversible (c'est-à-dire capable d'être un bon catalyseur pour la réaction d'oxydation de l'eau à l'anode H2O —-> 2 H+ + 2e– + 1/2 O2, et pour la réduction du proton H+ à la cathode H+ + 1e– —-> 1/2 H2).
Cet oxyde complexe de cobalt peut être produit à partir de divers sels de cobalt par voie électrochimique. Il a pu être complètement caractérisé grâce à la plateforme de « Nano-caractérisation » (PFNC) de DSM/DRT implantée à Minatec (Grenoble). C'est le premier matériau « commutable » ou « Janus », qui peut sous sa forme « réduite » (des nanoparticules de cobalt enrobées d’un oxo-phosphate de cobalt II) catalyser la production de H2 à pH neutre, et sous sa forme « oxydée » (un oxyde complexe de cobalt) produire O2 dans les mêmes conditions. On dispose ainsi d'un catalyseur universel à bas coût !
Références :
– Molecular Engineering of a Cobalt-based Electrocatalytic Nano-Material for H2 Evolution under Fully Aqueous Conditions,
E. S. Andreiadis, P.-A. Jacques, P. D. Tran, A. Leyris, M. Chavarot-Kerlidou, B. Jousselme, M. Matheron, J. Pécaut, S. Palacin, M. Fontecave, V. Artero, Nature Chemistry (2012) in press.
– A Janus cobalt-based catalytic material for electro-splitting of water,
S. Cobo, J. Heidkamp, P.-A. Jacques, J. Fize, V. Fourmond, L. Guetaz, B. Jousselme, R. Salazar, V. Ivanova, H. Dau, S. Palacin, M. Fontecave, V. Artero, Nature Materials 11 (2012) 802.
– Communiqué de presse CEA-CNRS-UJF Grenoble. Sur le site du CNRS. Sur le site de l'UJF (Grenoble).
Collaboration :
-
Laboratoire de Chimie et Biologie des Métaux (CEA/Université Grenoble 1/CNRS), 17 rue des Martyrs, 38054 Grenoble cedex 09, France
- Saioa Cobo, Pierre-André Jacques, Jennifer Fize, Vincent Fourmond, Marc Fontecave & Vincent Artero
-
FB Physik, Free University Berlin, Arnimallee 14, D-14195 Berlin, Germany
- Jonathan Heidkamp & Holger Dau
-
Institut LITEN, CEA LITEN/DEHT/LCPEM, 17 rue des Martyrs, F-38054 Grenoble cedex 9, France
- Laure Guetaz
-
CEA, IRAMIS, SPCSI, Chemistry of Surfaces and Interfaces group, F-91191 Gif sur Yvette Cedex, France
- Bruno Jousselme & Serge Palacin
-
CEA-Leti, MINATEC Campus, 17 rue des Martyrs, F-38054 Grenoble cedex 9, France
- Valentina Ivanova
-
Collège de France, 11 place Marcelin-Berthelot, 75231 Paris cedex 05, France
- Marc Fontecave





