La contamination bactérienne des surfaces est une problématique majeure dans de nombreux domaines, comme le médical ou l’agroalimentaire. La physiologie particulière des bactéries en surface et le développement de souches multi-résistantes sont deux facteurs qui réduisent l'efficacité des agents antimicrobiens.
Afin d’agir en amont de la formation du biofilm, dès la première étape de bio-adhésion, la stratégie retenue, dans le cadre du projet BRICAPAC (ANR PRCE), est de réaliser des surfaces bioactives par simple contact, permettant d'éliminer les bactéries sans relargage d’agents actifs. La solution trouvée par l'équipe du NIMBE/LICSEN, en collaboration avec une équipe de l'UMR SayFood INRAE-AgroParisTech, est de fonctionnaliser la surface de matériaux d’intérêt pour le domaine agroalimentaire, via le greffage covalent de polymères antibactériens. L'étude fait le lien entre la structure des polymères greffés et les propriétés biologiques obtenues.

La réalisation de surfaces antibactériennes actives demande de fixer de manière covalente un agent bactériostatique efficace, tout en préservant sa fonction.
Le choix de l'agent actif s'est porté sur les poly-ionènes (PI), polymères contenant des charges positives séparées par des segments hydrophobes de taille variable, qui se sont avérés particulièrement efficaces. Cet effet peut être modulé car il augmente avec la longueur des segments hydrophobes, c’est-à-dire le nombre de groupes méthylène entre les ammoniums quaternaires. Une gamme de PI a alors été synthétisée en faisant varier la longueur et la nature des segments (aliphatiques et éthers), ainsi que la masse molaire. L’impact de ces trois paramètres sur l’efficacité antibactérienne et la cytotoxicité ont été évalués. La gamme avec des segments aliphatiques se révèle être la plus bactériostatique, avec un gradient d’efficacité qui augmente avec la longueur du segment.
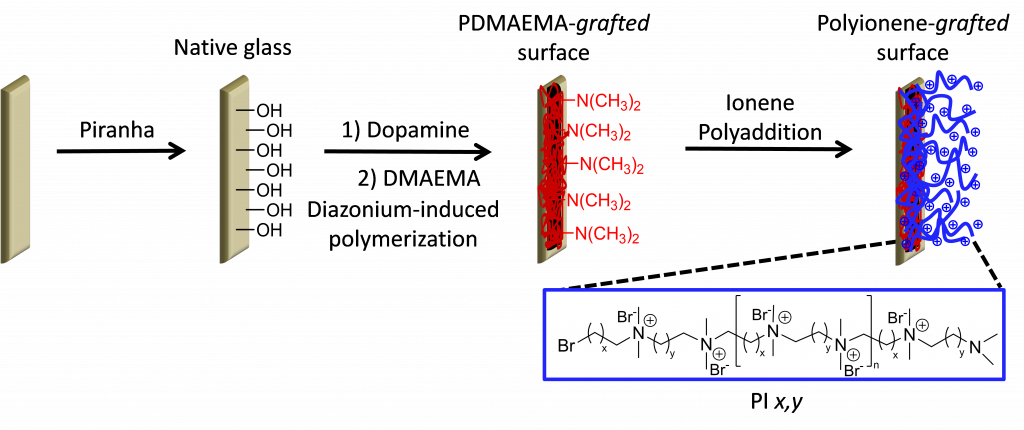
Le challenge de ce travail a été de développer une méthode robuste et reproductible pour greffer les PI de façon covalente sur des surfaces de verre et des wafers de silicium. La méthode retenue consiste en une procédure séquentielle combinant un dépôt de polydopamine, une étape de polymérisation induite par des sels de diazonium et la polyaddition en surface des ionènes (voir figure ci-dessous). Toutes les étapes de chimie ont été caractérisées en détail via diverses techniques d’analyse de surface (FTIR, XPS, énergies de surface et zétamétrie).
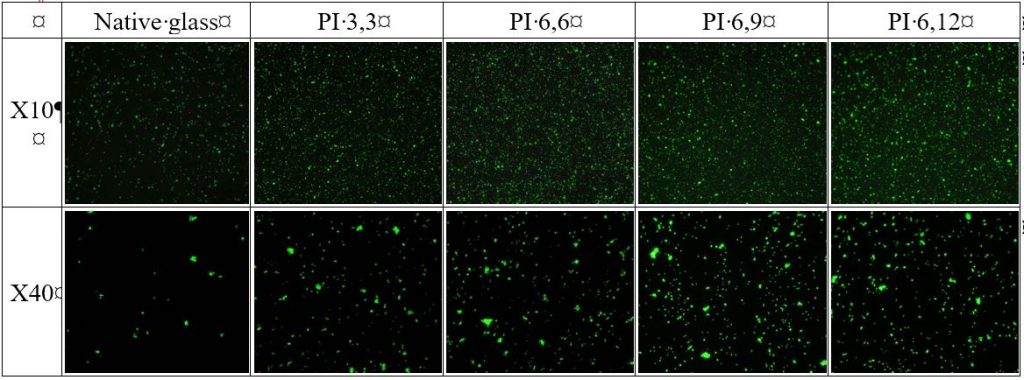
Les propriétés antibactériennes des surfaces greffées ont ensuite été évaluées par des mesures d’adhésion bactérienne consistant en un dénombrement des bactéries adhérentes (flore totale et cellules viable cultivables). Le résultat (figures ci-dessous) montre que les surfaces greffées PI présentent des propriétés bactériostatiques/bactéricides efficaces et modulables selon le type de PI, associées à un effet pro-adhésif important.
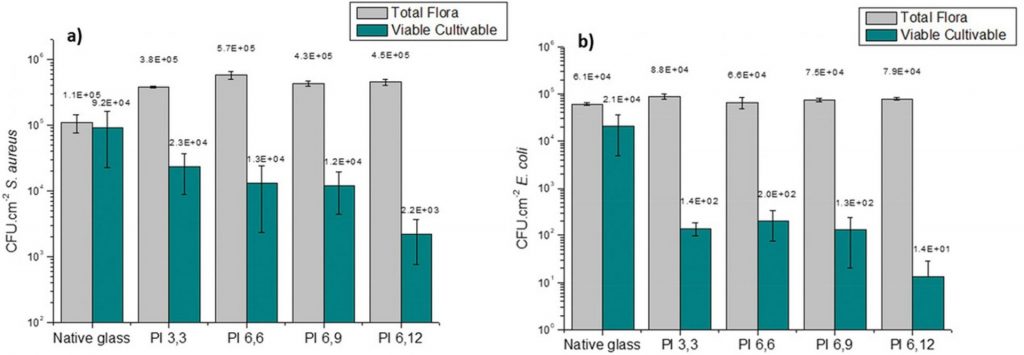
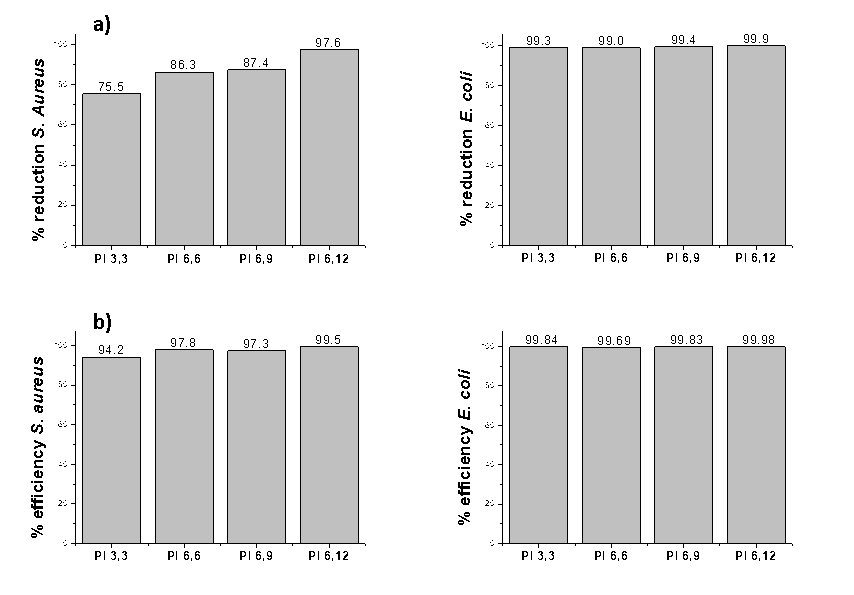
Les chaînes greffées en surface ont également été étudiées par réflectivité de rayons X et de neutrons pour évaluer avec précision la taille des couches polymères et tenter d’établir un lien entre la conformation des chaînes et leur mécanisme d’action sur les bactéries.
Dans le cadre du projet ANR BRICAPAC, impliquant des industriels de l'agroalimentaire, trois procédés ont été développés afin d’incorporer les PI sur des films de polyéthylène (PE), matériau principal des films alimentaires. Dans une première méthode, les PI sont greffés sur le PE via un procédé chimique analogue à celui sur le verre. Une seconde méthode a ensuite été développée, où la fonctionnalisation est effectuée par impression avec une encre à base de PI, suivi d'une exposition à une irradiation UV (recuit photonique) pour réticuler le PI. Enfin, dans le souci d’élaborer un procédé plus industrialisable, les PI ont été incorporés via un mélange-maître lors de l’extrusion du film de PE (collaboration BOLLORE Division Films Plastiques). Pour chacun de ces procédés, la possibilité de leurs applications dans le domaine agroalimentaire a été évaluée, en caractérisant quantitativement les propriétés antibactériennes et cytotoxiques des films PE modifiés.
Les résultats de ces travaux ont conduit à l'élaboration d'un second projet (COPOBAC : « Copolymères actifs à base de polyéthylène (PE) recyclé pour conférer des propriétés bactériostatiques aux films plastiques »), financé dans le cadre de l’appel valorisation du Labex NanoSaclay,
Références :
|
[1] « Robust grafting of polyionenes: new potent and versatile antimicrobial surfaces » S. Bernardi, M. Renault, A. Malabirade, N. Debou, J. Leroy, J.-M. Herry, M. Guilbaud, V. Arluison, M.-N. Bellon-Fontaine, G. Carrot Macromolecular Bioscience (2020).  |
 |
[2] « Procédé de préparation d’une surface à activité bactériostatique et surface ainsi préparée »
S. Bernardi, M.-N. Bellon-Fontaine, G. Carrot Brevet CEA-INRA PCT/FR2019/052921
[3] « Procédé de préparation d’une surface polymère à activité bactériostatique sur films plastiques au moyen d’une encre réticulée sous recuit photonique »
S. Bernardi, M. Guilbaud, F. Hauquier, G. Carrot, Brevet CEA-INRA FR2005148 (2020).
Contact CEA : Geraldine Carrot (équipe NIMBE/LICSEN du NIMBE, UMR 3685 CEA-CNRS).
Collaboration :
- Sarah Bernardi, Nabila Debou, Fanny Hauquier, Jocelyne Leroy, Géraldine Carrot, NIMBE, UMR CEA – CNRS, Université Paris-Saclay, CEA Saclay, Gif-sur-Yvette Cedex France
- M. Renault, J.-M. Herry, M. Guilbaud, M.-N. Bellon-Fontaine, SayFood, UMR AgroParisTech – INRAE, Université Paris-Saclay, Massy, France
- Antoine Malabirade, Véronique Arluison, Alexis Chennevière, LLB, UMR CEA – CNRS, Université Paris-Saclay, CEA Saclay, Gif-sur-Yvette Cedex, France.
- N. Badier, R. Floch, J. F. Glez Division Films plastiques, BOLLORE, Odet, 29556 Quimper Cedex, France.