La résonance magnétique nucléaire (RMN) est une technique d’analyse chimique très puissante. Au-delà du contraste usuel, fonction des temps de relaxation des spins nucléaires, le décalage en fréquence du signal RMN, issu d’atomes avec un environnement moléculaire différent (« décalage chimique »), offre une sélectivité spectroscopique.
Sur ce principe, des agents de contraste RMN sont obtenus en utilisant des atomes lourds engagés dans des complexes supramoléculaires. Le LSDRM a en particulier fait sa spécialité dans la conception de telles biosondes à base de RMN 129Xe, où le xénon polarisé en spin est encapsulé dans des molécules-cages fonctionnalisées par des ligands, conçus pour reconnaître des cibles spécifiques. Dans cette approche, l’effet de sélectivité spectrale (la résonance du xénon encagé prenant une fréquence spécifique, fonction par exemple de la nature précise de la cage) est ici complété par la haute sensibilité de la RMN apportée par l’hyperpolarisation de spin du gaz rare.
Pour concevoir et utiliser au mieux ces sondes, les équipes du LSDRM et du LCMCE de l’IRAMIS/NIMBE, en collaboration avec une équipe de l’IBiTec-S/SCBM, ont cherché à modéliser leurs paramètres RMN. Dans une publication dans Angewandte Chemie, ils rapportent les résultats remarquables obtenus par simulation, en excellent accord avec leurs résultats expérimentaux.
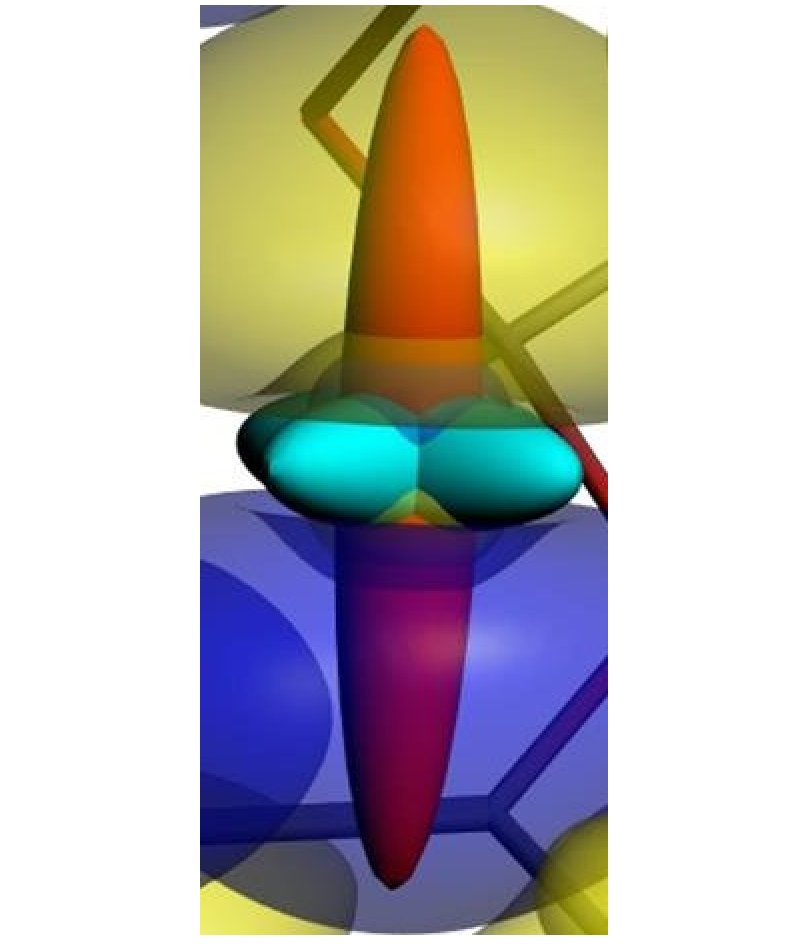
Une biosonde spectroscopique pour la RMN doit présenter plusieurs qualités :
- Un lien robuste et stable avec l’atome sonde, tel que le xénon encapsulé dans une molécule cage,
- Une fonctionnalisation de l’ensemble, pour une réactivité sélective avec des molécules cibles
- Une signature spectrale RMN spécifique de l’atome sonde, fonction par exemple de la nature de la cage, modifiée par réaction chimique avec la cible.
Les progrès obtenus en modélisation de composés chimiques complexes, et impliquant des éléments lourds, peuvent être aujourd’hui mis à profit pour mieux comprendre et maitriser la réalisation de telles sondes. La prédiction des paramètres RMN (tel que le décalage en fréquence du signal du 129Xe pour la sonde initiale et après réaction) serait un bon guide pour sélectionner de façon moins empirique les ligands des molécules-cages et obtenir la sélectivité spectrale recherchée. Ceci exige toutefois une compréhension approfondie de l’interaction hôte-invité (molécule cage – xénon), ce qui n’est pas une tâche facile.
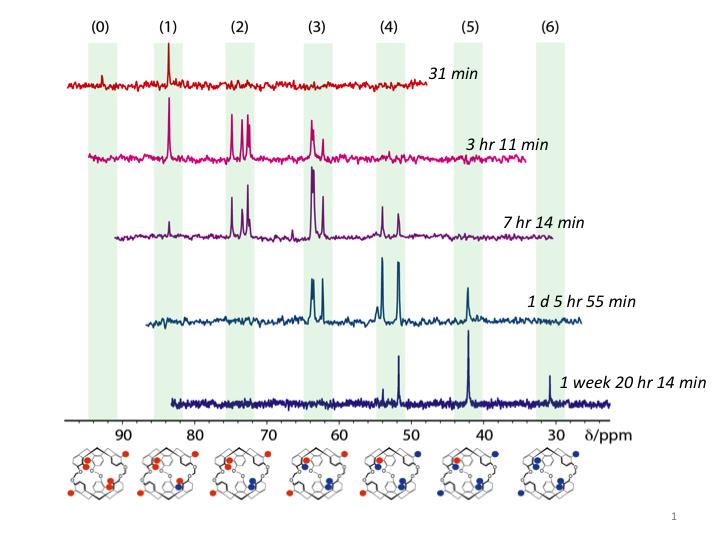
En collaboration avec DSV/iBiTec-S, des chercheurs de l’IRAMIS/NIMBE (LSDRM et LCMCE) ont étudié expérimentalement un système modèle par RMN du xénon hyperpolarisé, et l’ont simulé par chimie quantique. Comme système hôte du gaz rare, un cryptophane portant six groupes boronates a été synthétisé. Chaque fonction arylboronate peut être transformée en phénol par réaction avec l’eau oxygénée H2O2 (molécule cible), donnant naissance à sept composés différents possibles. De manière remarquable les fréquences de résonance RMN du xénon encapsulé sont réparties en sept groupes différents, séparées deux à deux par env. 10 ppm. Ainsi, le spectre RMN associé à la résonance du xénon évolue au fur et à mesure que se produit la réaction, et qu’apparaissent les groupements phénol (figure 1).
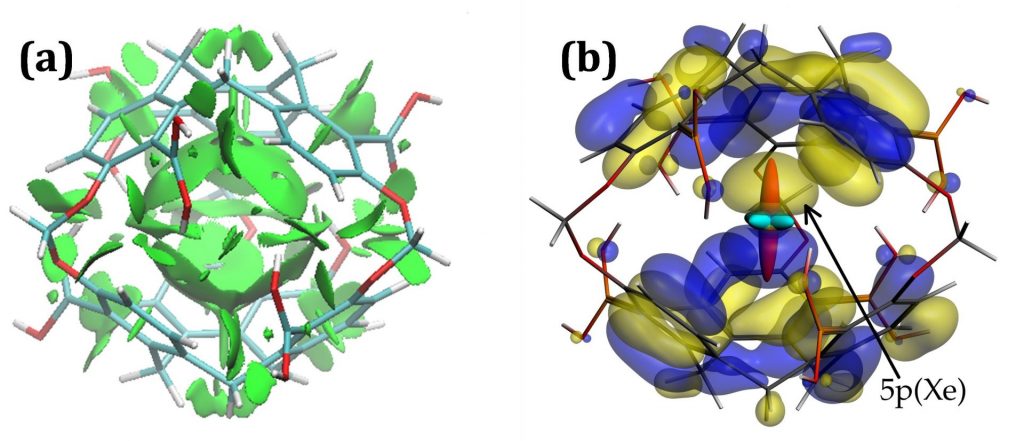
Le caractère très local de la théorie de la fonctionnelle de la densité ne permet pas de décrire les interactions de longue portée, en particulier la dispersion de London [1]). Les fonctionnelles de la densité « classiques » ne sont donc pas appropriées pour décrire les interactions xénon-hôte. Ici, la théorie de perturbation au second ordre de Møller-Plesset (MP2), qui, en incluant ces effets, est un bon compromis entre efficacité et précision, a été utilisée. Une combinaison d’analyses topologiques des orbitales et de décomposition de l’énergie d’interaction (EDA, voir référence 2) a permis de mieux comprendre la nature des interactions « hôte-invité » (figure ci-contre). Ceci conduit à des valeurs calculées des déplacements chimiques du xénon en excellent accord avec les valeurs expérimentales. Deux résultats principaux se dégagent :
- Pour tous les composés, le terme de dispersion représente la contribution dominante des interactions attractives xénon-hôte (60 %).
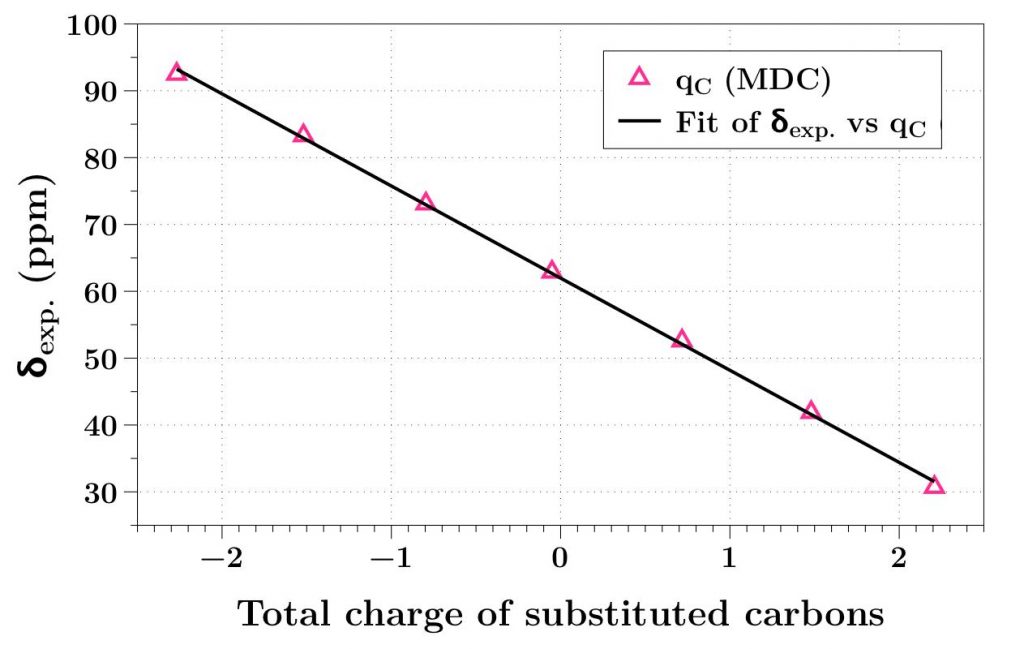
- Une excellente corrélation existe entre la charge globale des atomes de carbone qui portent les fonctions B(OH)2 ou OH et le déplacement chimique du xénon encapsulé (figure ci-dessous).
C’est la première fois qu’une telle précision est obtenue sur la prédiction des déplacements chimiques spectraux du xénon. Un tel modèle sera particulièrement utile pour étudier d’autres agents de contrastes impliquant des atomes lourds, ou concevoir des biosondes xénon « ciblées ». Reste aussi à comprendre les paramètres cinétiques de l’interaction, en tenant compte en particulier de l’effet de solvant, pour disposer d’un guide encore plus précis pour la conception de biosondes encore plus performantes.
[1] Terme de dispersion de London : Interaction dipôle-dipôle entre les dipôles instantanés induits par les fluctuations quantiques de densité électronique.
Références :
1) « Understanding a host-guest model system through 129Xe NMR experiments and theoretical chemistry »,
E. Dubost, J.-P. Dognon, B. Rousseau, G. Milanole, C. Dugave, Y. Boulard, E. Léonce, C. Boutin, P. Berthault, Angewandte Chemie 53(37) (2014) 9837.

2) Les méthodes d »analyse d’un complexe d’un élément lourd avec une molécule organique ou une cage inorganique, sont décrits en détail dans l’article :
« Theoretical insights into the chemical bonding in actinide complexes »
J.-P. Dognon, Coordination Chemistry Reviews 266–267 (2014) 110.
Voir le « Fil sciences et techno » CEA : « Conception de bio-sondes RMN, mode d’emploi…«
Contacts CEA-IRAMIS : J.-P. Dognon et P. Berthault.
Collaboration :
Emmanuelle Dubost1, Jean-Pierre Dognon2, Bernard Rousseau1, Gaëlle Milanole1, Christophe Dugave1, Yves Boulard3, Estelle Léonce, Céline Boutin3, Patrick Berthault3,
- 1IBiTec-S/SCBM, LabEx LERMIT, CEA Saclay, F-91191 Gif-sur-Yvette,France
- 2Laboratoire de Chimie Moleculaire et Catalyse pour l’Energie, IRAMIS/NIMBE,
URA 3299 CEA/CNRS, CEA Saclay, F-91191 Gif sur Yvette, France - 3Laboratoire Structure et Dynamique par Résonance Magnétique, IRAMIS/NIMBE,
URA 3299 CEA/CNRS, CEA Saclay, F-91191 Gif sur Yvette, France.




