Nuclear Magnetic Resonance enables the study of molecular structure and dynamics by acquiring high-resolution spectra and measuring relaxation times. Measurable relaxation times are typically of the order of the precession period of the magnetic moment as it returns to equilibrium, and are therefore a function of the value of the polarizing magnetic field. A collaboration of researchers from ENS-Paris and IRAMIS has developed an original method which, by varying the polarizing magnetic field, enables the slow and fast relaxations of the same molecular system to be measured, while preserving high spectral resolution.
La résonance magnétique nucléaire (RMN) est une méthode très puissante d’étude d’un système moléculaire. La combinaison des mesures structurales par l’acquisition de spectres RMN à haute résolution et de dynamique moléculaire, par la mesure des temps de relaxation associés, permet l’analyse des mouvements moléculaires sur plusieurs échelles de temps allant de 10-12 sec pour les rotations/vibrations, à quelques secondes pour des phénomènes d’échange chimique.
Dans une mesure RMN, le moment magnétique initialement aligné sur le champ magnétique statique polarisant de l’aimant de RMN, est désorienté par l’application d’une impulsion radiofréquence. Le moment magnétique retourne à sa valeur l’équilibre en suivant un mouvement de précession à la fréquence dite de Larmor, fonction de la valeur du champ statique. Le temps de relaxation longitudinal, temps caractéristique pour le retour de l’aimantation nucléaire à sa valeur d’équilibre thermodynamique, est ainsi du même ordre que cette fréquence de Larmor. Sa mesure informe sur les mouvements qui ont lieu à cette échelle de temps. Pour les champs les plus intenses utilisés (14 Teslas), les fréquences de Larmor sont de l’ordre de 600 MHz et ces mesures nous informent sur les mouvements ultra-rapides, tels que les vibrations moléculaires.
Si l’on souhaite caractériser des mouvements lents (de l’ordre de la seconde) par relaxométrie, le champ statique doit être bien inférieur, typiquement entre le champ terrestre et 1 Tesla. Cependant pour ces faibles valeurs de champ, la résolution spectrale est fortement dégradée, et l’on mesure ainsi une relaxation globale associée à l’ensemble des groupements chimiques des molécules étudiées. Cette mesure garde son intérêt, mais on pourrait souhaiter être plus précis dans le cas où seule une partie de la molécule effectue un mouvement lent, par exemple un petit ensemble d’acides aminés dans une protéine. Ainsi, pour obtenir les temps de relaxation lents pour chaque groupement chimique individualisé, il faut combiner des mesures de temps de relaxation à faible champ et des informations spectrales à fort champ.
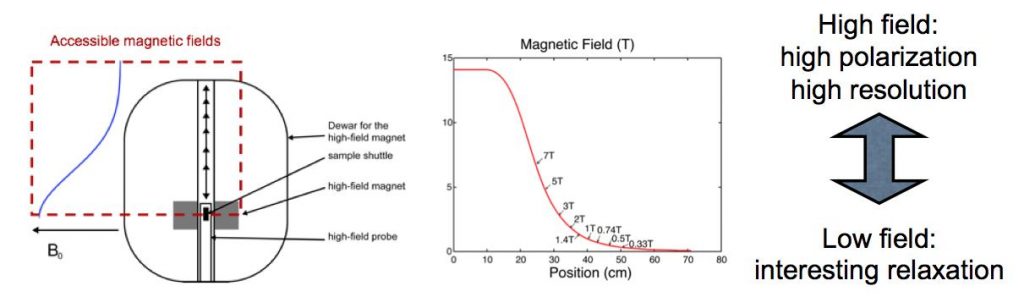
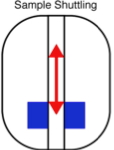
Principe de la mesure de relaxométrie haute résolution par RMN : L’échantillon est plongé au centre de l’aimant supraconducteur dans un champ uniforme et très intense. L’échantillon fortement polarisé est ensuite rapidement déplacé le long de l’axe de l’aimant en position de champ de fuite permettant de mesurer des temps de relaxation lents. Enfin, l’échantillon est replacé en champ fort au centre de l’aimant, pour enregistrer son spectre RMN à haute résolution.
Pour effectuer ces doubles mesures corrélées, à bas champ et haut champ, une collaboration de chercheurs de l’IRAMIS/NIMBE, de l’École Normale Supérieure de Paris, de l’EPFL/ISIC à Lausanne et de la Sté Brücker, propose un système de navette de translation rapide de l’échantillon, d’une zone de fort champ à une zone bas champ. L’échantillon est ainsi déplacé depuis la zone de champ polarisant homogène (14 T), au centre de l’aimant supraconducteur (permettant d’observer un spectre à haute résolution), à une position distante dans le champ de fuite (de l’ordre du champ magnétique terrestre) sur l’axe de l’aimant. La période de va-et-vient est typiquement de 100 ms, permettant la mesure indirecte du temps de relaxation pour plusieurs valeurs du champ traversé, tout en préservant l’information spectrale haute résolution, donnée par le déplacement chimique des fréquences de résonance.
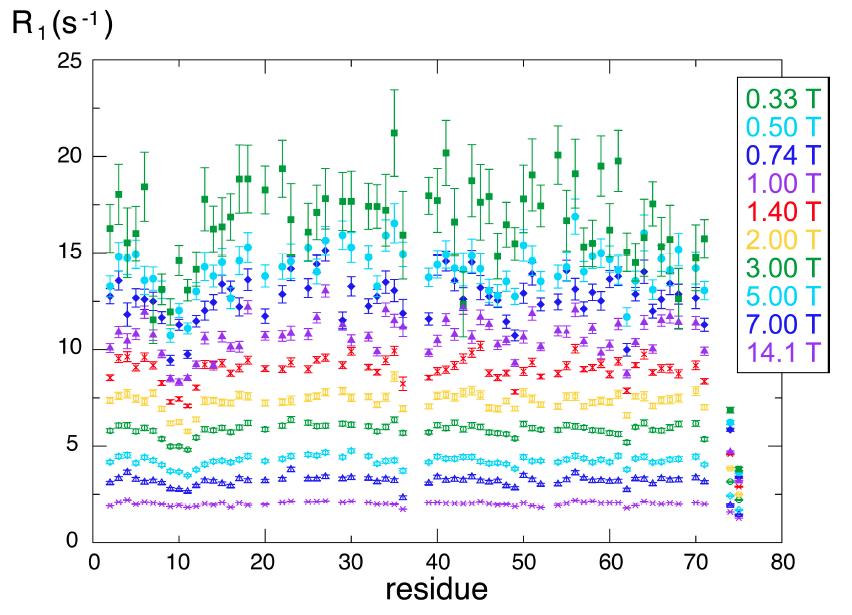
La méthode proposée a été utilisée avec succès pour la mesure du temps de relaxation longitudinal pour les noyaux d’azote-15 de la protéine ubiquitine. Les mesures ainsi effectuées pour plusieurs valeurs du champ magnétique polarisant mettent en évidence des mouvements lents (associés à de longs temps de relaxation) sur certains résidus du squelette de la molécule de l’ubiquitine, ce qui permet une modélisation et une compréhension plus détaillées de sa dynamique moléculaire.
References:
“Nanosecond timescale motions in proteins revealed by high-resolution NMR relaxometry”
C. Charlier, S. Khan, T. Marquardsen, P. Pelupessy, V. Reiss, D. Sakellariou, G. Bodenhausen, F. Engelke and F. Ferrage, J. Am. Chem. Soc., 135, 18665 (2013)
Le projet a été financé par l’ANR blanc SIMI 7 “DYNIDP”.
Contact CEA : Dimitrios Sakellariou (IRAMIS/NIMBE/LSDRM).
Collaboration:
- Laboratoire des Biomolécules, Département de Chimie, UMR 7203 CNRS-UPMC-ENS, École Normale Supérieure, 24 Rue Lhomond, 75231 Paris Cedex 05, France
- Bruker BioSpin GmbH, Silberstreifen 4, D 76287 Rheinstetten, Germany
- Laboratoire Structure et Dynamique par Résonance Magnétique, UMR 3299-SIS2M CEA/CNRS, IRAMIS, DSM, CEA Saclay, F-91191, Gif-sur-Yvette Cedex, France
- Institut des Sciences et Ingénierie Chimiques, Ecole Polytechnique Fédérale de Lausanne, BCH, 1015 Lausanne, Switzerland.



