Pour le stockage de l’énergie, les batteries lithium-oxygène (Li-O2) sont envisagées comme une alternative prometteuse aux batteries lithium-ion actuelles. Elles offrent en effet des énergies spécifiques théoriques bien plus élevées que les batteries actuelles (~ 3500 Wh/kg vs. 160 Wh/kg pour le Li-ion). Cette technologie pose cependant encore un certain nombre de défis, le plus important étant la perte rapide de performance après seulement quelques cycles de charge / décharge. Les verrous à lever pour développer cette technologie résident essentiellement dans la recherche de nouveaux matériaux d’électrode positive, souvent appelée « cathode à air ».
Lors du fonctionnement de la batterie Li-O2, cette cathode à air est le siège de réactions électrochimiques avec la réduction de l’oxygène, lors de la décharge ou un dégagement d’oxygène lors de la charge. La cathode à air doit aussi être capable de stocker les produits formés lors de la décharge, comme le peroxyde de lithium Li2O2, insoluble dans l’électrolyte aprotique (sans ion H+) utilisé.
Parmi les matériaux de cathode à air envisagés, les solides poreux de type Metal-Organic Framework (MOFs) semblent de bons candidats. Les MOFs présentent en effet une grande surface spécifique et une forte porosité. Leur structure avec une charpente ouverte fournit non seulement un réseau hôte pour la diffusion des ions lithium et une bonne diffusion de l’oxygène, mais aussi un espace suffisant pour le dépôt des produits de décharge.
Afin de répondre aux futurs besoins de stockage d’énergie, il est nécessaire de développer de nouvelles technologies de batteries offrant de meilleures capacités. Parmi les systèmes possibles, la technologie lithium-air / lithium-oxygène offre des perspectives qui semblent prometteuses. En effet, leur densité énergétique théorique est nettement plus élevée que celles des batteries lithium-ion actuelles (~ 3 500 Wh/kg, soit 25% de celle des carburants pétroliers, vs. 160 Wh/kg pour le lithium-ion) [1]. Cependant, cette technologie demande encore de nombreux efforts de développements et de multiples défis restent à relever : le principal concerne le nombre limité de cycles de charge /décharge. Une autre limitation importante réside dans l’obligation d’utiliser un air purifié, voire du dioxygène pur.
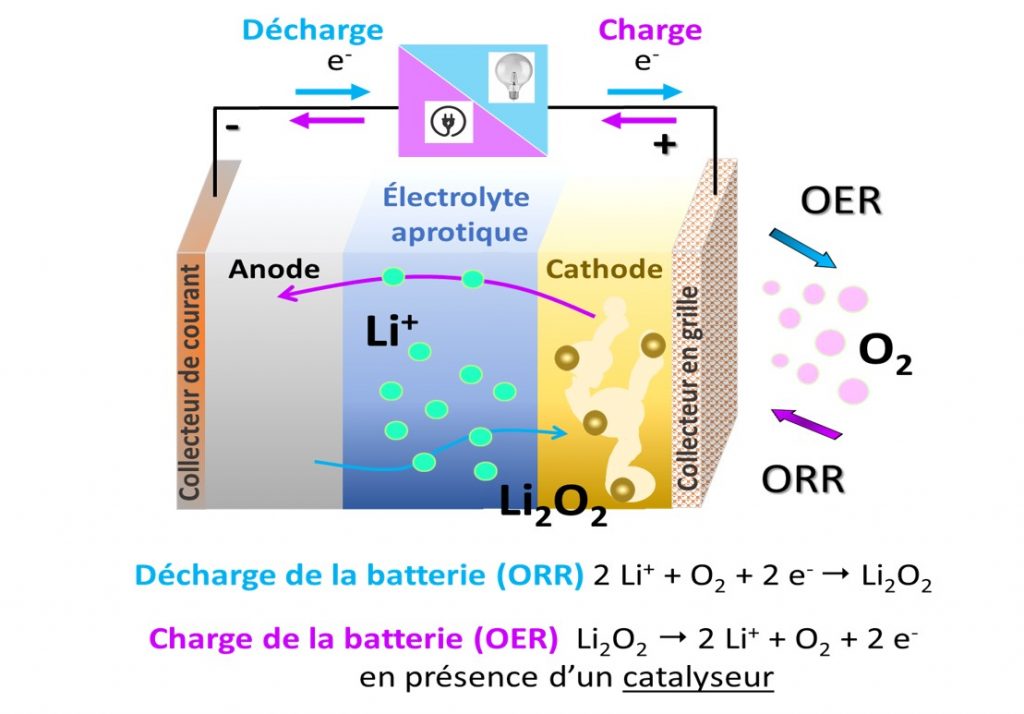
Principe de fonctionnement d’une batterie lithium oxygène en milieu organique aprotique (sans ion H+) : lors de la charge, une réduction de l’oxygène (ORR : Oxygen Reduction Reaction) se produit à la cathode poreuse tandis que les produits de décharge sous la forme Li2O2 se décomposent lors de la charge (OER : Oxygen Evolution Reaction).
Une batterie Li-O2 est constitué d’une anode métallique en lithium et d’une cathode à air séparée par une membrane imbibée d’électrolyte qui peut être aprotique, soit sans ion H+ tel qu’un sel de lithium dissout dans un solvant organique, ou aqueux (voir figure). La cathode à air est généralement composée de carbone poreux présentant une surface spécifique élevée. Lors de la décharge, l’anode métallique de lithium s’oxyde, libérant des ions Li+ dans l’électrolyte, la réaction s’inverse lors de la charge. A la cathode à air, l’oxygène entre dans l’électrode poreuse, se dissout dans l’électrolyte et est réduit (O2 → 2 O2-) à la surface de l’électrode lors de la décharge. En milieu aprotique, l’ion O2- réagit ensuite avec les ions Li+ de l’électrolyte pour former des peroxydes de lithium Li2O2. Ces produits de décharge sont insolubles dans les électrolytes organiques et nécessitent d’être stockés dans la cathode poreuse. Lors de la charge, il a été montré que ces produits de décharge peuvent être réversiblement décomposés en présence d’un catalyseur [2].
Les matériaux hybrides poreux de type Metal-Organic Framework (MOF) font l’objet de nombreuses études en raison de leurs diversités structurales et de leurs applications potentielles comme matériaux pour le stockage de l’énergie [3] ou encore leurs propriétés catalytiques [4]. Ces solides sont construits à partir de l’assemblage de briques inorganiques métalliques reliés entre elles par des ligands organiques via des liaisons de coordinations fortes pour former des réseaux cristallins multidimensionnels. On distingue les MOFs à structure rigide (dont la porosité est permanente) et les MOFs flexibles, dont la structure semble respirer de manière réversible suite à un stimulus extérieur : température, adsorption de molécules hôtes.
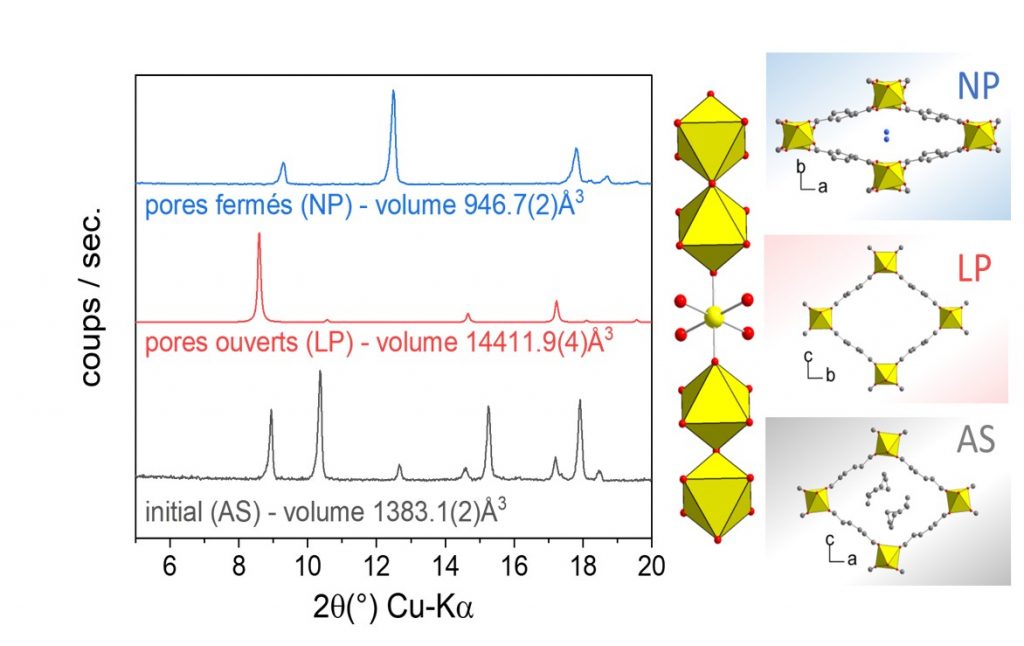
Diagrammes de diffraction des rayons X (Kα-Cu = 1.54 Å) mettant en en évidence les transitions de phases observées en présence d’un stimulus extérieur : transition en température (AS ⇔ LP) ou adsorption de molécules d’eau (LP ⇔ NP).
L’équipe du LEEL/NIMBE, en collaboration avec une équipe de l’IMAP à l’ESPCI, a choisi d’étudier les propriétés électrochimiques d’un MOF flexible en tant que cathode à air pour les batteries Li-O2 [5]. Les solides MIL-53 (Al)* ont été synthétisés selon deux méthodes (hydrothermale H et micro-onde MW), conduisant à des tailles de particules et des morphologies différentes. La structure du matériau MIL-53(Al) est construite à partir de chaînes d’octaèdres métalliques (AlO4(OH)2) constituant la brique inorganique, reliées entre elles par des ligands d’acide carboxylique (acide 1,4-benzenedicarboxylique HOOC-C6H4-COOH – BDC) pour former un réseau de canaux poreux unidimensionnels dont la section est en forme de losange.
Des transitions de phases sont observées lors du retrait du résidu de synthèse ou en présence de molécules d’eau dans les pores (voir figure ci-dessous).
Les tests électrochimiques réalisés avec des électrodes de MIL-53 montrent de bonnes performances quelle que soit la méthode de synthèse. Comme le montre la figure, plusieurs comportements sont observés selon la valeur initiale de la capacité Q1 suite à la première charge :
- pour Q1 > 900 mAh/g) : les capacités ultérieures chutent rapidement et deviennent très faibles (Q2 100-300 mAh/g).
- pour les valeurs de Q1 modérées (500-900 mAh/g) , la capacité à la charge est équivalente à la capacité de décharge, ce qui montre que la réaction ORR a lieu.
- pour les valeurs de Q1 très faibles (< 300 mAh/g) : la capacité Q2 est élevée, les réactions de réduction de l’oxygème (ORR) et de décomposition du Li2O2 (OE)R se mettent en place.
Cependant, quel que soit le comportement électrochimique, le nombre de cycles de charge / décharge à pleine capacité restent très limités.
Les études ex situ (DRX, SEM et XPS) ont été réalisées sur la cellule démontée après 1 puis 10 décharges. Celles-ci confirment la nature du produit de décharge formé (Li2O2) et montrent que ce dernier est bien encapsulé dans les pores du solide MIL-53.
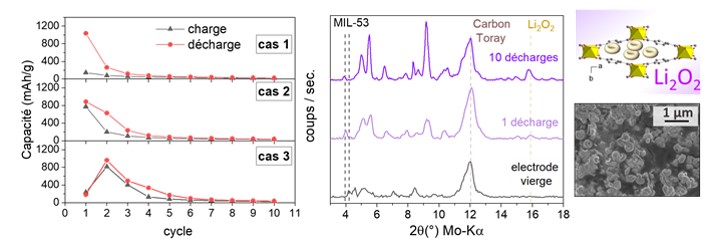
A gauche : évolution des capacités de charge et décharges, lors des premiers cyclages charge-décharge avec des électrodes de MIL-53. A droite : évolution des diagrammes de diffraction de rayons X (Kα-Mo = 0.71 Å) en fonction du nombre de cycle charge / décharge.
Cette étude montre ainsi que les solides flexibles de type MOFs sont de bons candidats en tant que cathode poreuse pour les batteries Li-O2. Cependant la faible conductivité de ces matériaux et l’inertie du centre métallique (Al) limite leurs performances. Ce travail se poursuit en considérant d’autres centres métalliques (Fe, V)
* MIL : Matériau de l’Institut Lavoisier
Références :
[1] « Lithium-Oxygen Batteries and Related Systems: Potential, Status, and Future »
W.-J. Kwak, Rosy, D. Sharon, C. Xia, H. Kim, L. Johnson, P. Bruce, L. Nazar, Y. Sun, A. Frimer, M. Noked, S. Freunberger, D. Aurbach, Chemical Reviews 120,6626 (2020).
[2] « A review of cathode materials and structures for rechargeable lithium–air batteries »
Z. Ma, X. Yuan, L. Li, Z.-F. Ma, D.P. Wilkinson, L. Zhang, J. Zhang, Energy Environ. Sci. 8, 2144 (2015).
[3] « Metal–Organic Frameworks (MOFs) and MOF-Derived Materials for Energy Storage and Conversion »
X. Zhang, A. Chen, M. Zhong, Z. Zhang, X. Zhang, Z. Zhou, X.-H. Bu, Electrochem. Energ. Rev. 2, 29 (2019).
[4] « Metal–organic framework materials as catalysts »
J. Lee, O. K. Farha, J. Roberts, K. A. Scheidt, S. T. Nguyen, J. T. Hupp, Chemical Society Reviews. 38, 1450 (2009).
[5] « MIL-53 Metal–Organic Framework as a Flexible Cathode for Lithium-Oxygen Batteries »
Y. Zhang, B. Gikonyo, H. Khodja, M. Gauthier, E. Foy, B. Goetz, C. Serre, S. Coste Leconte, V. Pimenta, S. Surblé, Materials. 14, 4618 (2021).
Contact CEA-IRAMIS : Suzy Surblé (NIMBE/LEEL UMR CEA-CNRS).
Collaboration :
- B. Goetz, V. Pimenta & C. Serre
Institut des Matériaux Poreux de Paris (IMAP), ESPCI Paris, Ecole Normale Supérieure de Paris, CNRS, PSL University, 75005 Paris, France - S. Coste Leconte
INSTN, Ecole de spécialisation des énergies bas carbone et des technologies de la santé, Unité d’Enseignement de Saclay, CEA, 91191 Gif-sur-Yvette, France.




