Caractérisation du devenir de nano-assemblages thérapeutiques dans un milieu biologique
Le projet de recherche Nanoprotection regroupe six laboratoires dont quatre du Labex NanoSaclay. Quatre chercheurs du LIONS sont impliqués: Frédéric Gobeaux, Jean-Philippe Renault, Fabienne Testard et Patrick Guenoun. Ce projet a pour but de développer une nouvelle approche thérapeutique par des nanoparticules squalénées pour traiter deux maladies neurodégénératives : la maladie de Charcot Marie Tooth 1A et les lésions dues à des traumatismes du plexus brachial.Mise au point par l’équipe de Patrick Couvreur (Institut Galien, Faculté de Pharmacie de Chatenay-Malabry) en 2006, la squalénoylation de nucléosides ou nucléosides dérivés permet d’obtenir des suspensions aqueuses de nanoparticules de principes actifs via le procédé simple et peu coûteux en énergie de nanoprécipitation.1,2 Les nanoparticules obtenues permettent un fort taux d’encapsulation en principe actif, en le protégeant d’une dégradation trop rapide et en ciblant spatialement et temporellement sa délivrance.
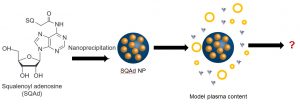
L’objectif de notre équipe au sein du projet Nanoprotection est d’étudier la structure et le devenir des nanoparticules de Squalène-Adénosine (SqAd) en milieu biologique. Aujourd’hui, peu de choses sont encore connues sur la structure de nanomédicaments organiques (liposomes, vésicules, nanoparticules,..) dans le sérum ou le cytoplasme. La principale difficulté de caractérisation in situ vient de la similitude des fonctions et atomes de ces objets avec le milieu biologique. Cette caractérisation est encore plus complexe pour les nanoparticules labiles telles que celles de SqAd.
Caractériser les nanoparticules de SqAd avant et après leur injection est nécessaire pour in fine contrôler leur préparation et comprendre leur devenir dans l’organisme. La contribution du LIONS consiste à développer des stratégies originales pour suivre in vitro la structure et la distribution en taille des nanoparticules dans un milieu biologique modèle. Nous utilisons notre expertise des milieux dispersés et complexes pour étudier spécifiquement ces nanoparticules de principes actifs en milieu biologique.3–5
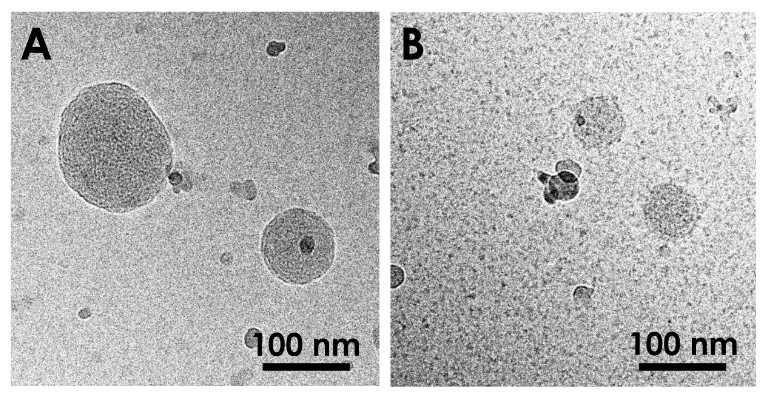
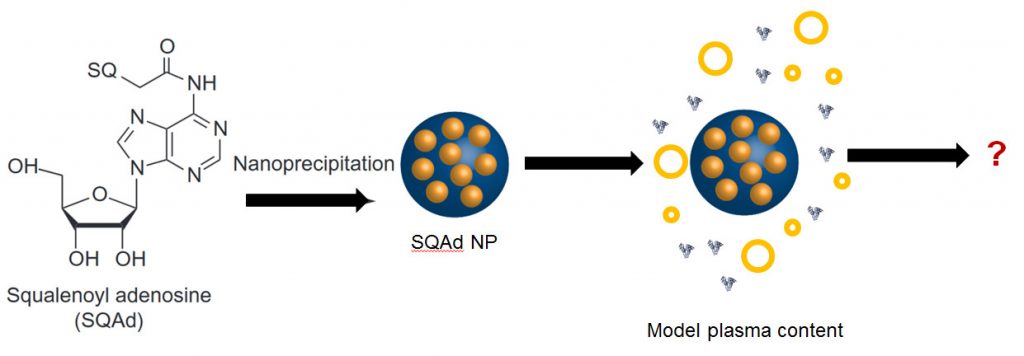
Parmi les différentes possibilités de caractérisation, la diffusion de neutrons aux petits angles (SANS) permet de suivre les fluctuations de densité à l’échelle nanométrique. Récemment, nous avons démontré l’efficacité de cette approche pour suivre les étapes de formation de composés squalénés (gemcitabine et deoxycitidine).6 Nous avons ainsi démontré le contrôle de la distribution en taille par l’activité du solvant et l’existence d’une structure interne dès les premières étapes de leur formation.
Nous mettons à profit ces premiers résultats pour étudier la structure des nanoparticules de SqAd puis développer des méthodologies particulières afin de suivre leur évolution en milieu biologique modèle. La première phase consiste à suivre les nanoparticules dans un sérum deutéré, puis à deutérer une partie de la molécule pour la suivre dans un sérum hydrogéné. Parallèlement à ces études de structures, nous suivons plus spécifiquement les interactions entre les nanoparticules de SqAd et des composés choisis du sérum (albumine, lipoprotéines etc…) par différentes techniques de spectroscopies et de calorimétrie.7–10 Ces dernières études ont constitué l'objet du sujet de stage de fin d'étude de Joëlle Bizeau de mars à août 2017 (ENSIACET/Master Chimie Fine et Appliquée de l'Université Paul Sabatier Toulouse).
Références
(1) Squalenoyl Nanomedicines as Potential Therapeutics.
Couvreur, P.; Stella, B.; Reddy, L. H.; Hillaireau, H.; Dubernet, C.; Desmaële, D.; Lepêtre-Mouelhi, S.; Rocco, F.; Dereuddre-Bosquet, N.; Clayette, P.; et al. Nano Lett. 2006, 6 (11), 2544–2548.
(2) Discovery of New Hexagonal Supramolecular Nanostructures Formed by Squalenoylation of an Anticancer Nucleoside Analogue.
Couvreur, P.; Reddy, L. H.; Mangenot, S.; Poupaert, J. H.; Desmaële, D.; Lepêtre-Mouelhi, S.; Pili, B.; Bourgaux, C.; Amenitsch, H.; Ollivon, M. Small 2008, 4 (2), 247–253.
(3) Structural Determinants for Protein Adsorption/Non-Adsorption to Silica Surface.
Mathé, C.; Devineau, S.; Aude, J.-C.; Lagniel, G.; Chédin, S.; Legros, V.; Mathon, M.-H.; Renault, J.-P.; Pin, S.; Boulard, Y.; et al. PLoS ONE 2013, 8 (11), e81346.
(4) Interferences of Silica Nanoparticles in Green Fluorescent Protein Folding Processes.
Klein, G.; Devineau, S.; Aude, J. C.; Boulard, Y.; Pasquier, H.; Labarre, J.; Pin, S.; Renault, J. P. Langmuir 2016, 32 (1), 195–202.
(5) Structure and Function of Adsorbed Hemoglobin on Silica Nanoparticles: Relationship between the Adsorption Process and the Oxygen Binding Properties. Devineau, S.; Zargarian, L.; Renault, J. P.; Pin, S. Langmuir 2017, 33 (13), 3241–3252.
(6) The Role of Solvent Swelling in the Self-Assembly of Squalene Based Nanomedicines.
Saha, D.; Testard, F.; Grillo, I.; Zouhiri, F.; Desmaele, D.; Radulescu, A.; Desert, S.; Brulet, A.; Couvreur, P.; Spalla, O. Soft Matter 2015, 11 (21), 4173–4179.
(7) Measuring Protein Structure and Stability of Protein–Nanoparticle Systems with Synchrotron Radiation Circular Dichroism.
Laera, S.; Ceccone, G.; Rossi, F.; Gilliland, D.; Hussain, R.; Siligardi, G.; Calzolai, L. Nano Lett. 2011, 11 (10), 4480–4484.
(8) Sensing of Hydrophobic Cavity of Serum Albumin by an Adenosine Analogue: Fluorescence Correlation and Ensemble Spectroscopic Studies.
Nag, M.; Bera, K.; Chakraborty, S.; Basak, S. J. Photochem. Photobiol. B 2013, 127, 202–211.
(9) Interaction of Bovine Serum Albumin with Self-Assembled Nanoparticles of 6-O-Cholesterol Modified Chitosan.
Li, X.; Chen, M.; Yang, W.; Zhou, Z.; Liu, L.; Zhang, Q. Colloids Surf. B Biointerfaces 2012, 92, 136–141.
(10) Interaction of Glutathione with Bovine Serum Albumin: Spectroscopy and Molecular Docking.
Jahanban-Esfahlan, A.; Panahi-Azar, V. Food Chem. 2016, 202, 426–431.
© Ce projet est soutenu par une subvention publique supervisée par l'Agence Nationale de la Recherche (ANR) dans le cadre du programme 'Investissements d'Avenir' (Labex NanoSaclay, référence: ANR-10-LABX-0035), coordonnée par Liliane Massade.