Les déchets plastiques rejetés dans la nature se fragmentent jusqu'à former des micro- et nano-particules. De plus en plus de missions exploratoires et d’études montrent que ces particules sont aujourd'hui présentes dans de nombreux compartiments environnementaux. Devenues invisibles à l'œil nu, elles représentent une face cachée de la pollution plastique, dont on mesure encore mal l'influence sur le vivant.
Les fragments de plastique sont naturellement hydrophobes, et l'étude menée par deux équipes du NIMBE et de l'I2BC au CEA, associés à l'INRAE et l'IMMM, montre que l'adjonction d’une couronne de molécules biologiques permet leur dispersion dans l’eau [1].
Il est ensuite montré que si cette couche favorise ainsi l’entrée et la dispersion des microplastiques dans l’environnement, elle permet également de proposer des stratégies « low tech » pour les collecter.
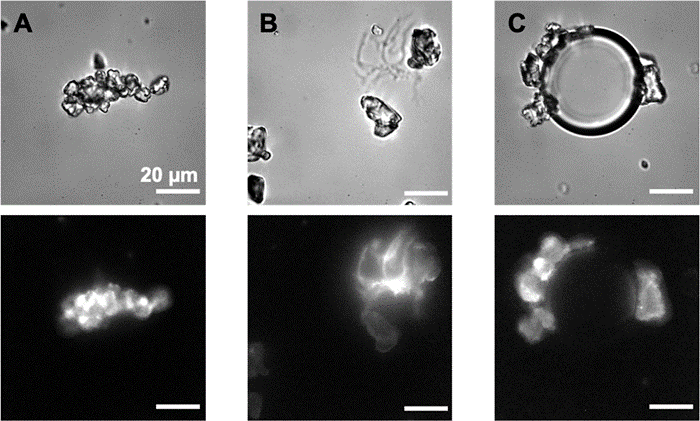
Micro et nanoplastiques (MNP) constituent une pollution diffuse émergente qui suscite de nombreuses inquiétudes environnementales. Faute de connaitre leurs propriétés physiques, chimiques et leurs interactions biologiques, on a encore du mal à prendre toute la mesure de l’étendue et de l’impact de cette pollution.
Les équipes de l'I2BC et du NIMBE au CEA, associées à l'IMMM, à l’Université Paris Cité (BFA) et au Synchrotron Soleil ont donc allié leurs compétences pour étudier de façon approfondie le comportement de microplastiques modèles dans l’eau et le rôle que peuvent jouer les protéines qui s'adsorbent à leur surface (formation d'une « corona ») [1]. Dans l’environnement naturel, les particules de plastiques se couvrent en effet rapidement d’une couche de molécules d’origine biologique [2], ce qui va modifier leur comportement.
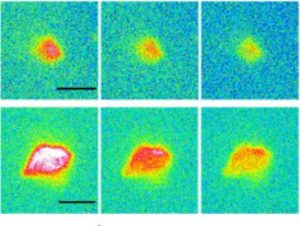
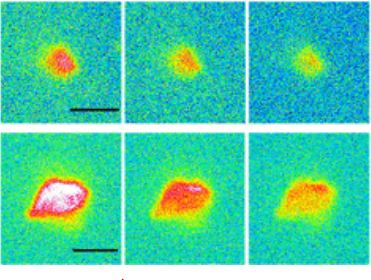
Les études ont porté plus spécifiquement sur le comportement de microparticules (diamètre de 5 et 10 µm) de polypropylène et de polyéthylène, les plastiques les plus persistants dans l’environnement, mises en présence de protéines. Il est premièrement observé que sans protéines, la poussée d'Archimède et les forces capillaires tendent à rassembler les particules vers la surface (« crémage ») et très peu de particules subsistent en solution. À l'opposé, il est observé que les biomolécules agissent comme un surfactant rendant les plastiques hydrophiles, ce qui permet leur diffusion dans l'eau et favorise leur dispersion. De plus, la couronne génère une interaction globalement répulsive entre particules qui empêche leur agglomération. Après 24 heures sans agitation, la quantité de microplastiques en suspension dans l’eau peut ainsi rester supérieure à 1011 particules par litre. La stabilisation observée augmente avec la qualité structurale de la couronne protéique, qui a pu être appréciée par imagerie sur la ligne Disco du synchrotron Soleil.
Image de microplastiques de polyéthylène agrégés par des protéines :
En haut, images de microscopie optique. En dessous, images des protéines présentes dans les mêmes agrégats, obtenues par microscopie de fluorescence en UV lointain au Synchrotron Soleil.
Au-delà de la simple observation du comportement des particules de plastiques en présence de protéines, il est également montré qu'en contrôlant la couronne protéique, il devient possible de manipuler les microplastiques en solution. Deux voies de déstabilisation de la couronne protéique ont été testées :
- la précipitation, induite par des teneurs élevées en sel (sulfate d'ammonium, solution saturée, 5.3 M de (NH4)2SO4),
- un traitement thermique (~80°c / 1h) conduisant à l'agrégation des protéines.
Dans ces 2 conditions, la corona des microparticules est fortement déstabilisée, ce qui entraîne le crémage d'environ 95 % des microparticules après 24 heures.
Le traitement thermique, simple à mettre en œuvre et « low Tech » pourrait être intéressant pour, par exemple, purifier l'eau et la rendre potable, là où des solutions industrielles de dépollution ne sont pas disponibles. On peut noter aussi que cette méthode se rapproche dans son principe des méthodes traditionnelles de clarification du vin par « collage », où les protéines du blanc d’œuf (albumine) coagulent au contact des tanins et permettent d'extraire les particules indésirables initialement en suspension.
La même stratégie fonctionnerait-elle également pour les particules de taille nanométriques (nanoplastiques), plus complexes à étudier ? Leur plus grande surface devrait favoriser l'adsorption des protéines, et donc la possibilité de contrôler leur stabilité en solution par une action directe sur la couronne protéique. Reste à conduire les expériences, avec d'autres méthodes mieux adaptées à des particules de cette taille submicronique…
Références :
[1] « Role of the Protein Corona in the Colloidal Behavior of Microplastics” M. Schvartz, F. Saudrais, S. Devineau, S. Chédin, F. Jamme, J. Leroy, K. Rakotozandriny, O. Taché, G. Brotons, S. Pin, Y. Boulard, & J-P Renault, Langmuir 2023, 39, 12, 4291–4303.
[2] “A proteome scale study reveals how plastic surfaces and agitation promote protein aggregation”
M. Schvartz, F. Saudrais, S. Devineau, J-C Aude, S. Chédin, C. Henry, A. Millán-Oropeza, T. Perrault, L. Pieri, S. Pin, Y. Boulard, G. Brotons & J-P Renault. Scientific Reports volume 13, Article number: 1227 (2023).
Voir le fait marquant CEA Joliot-IRAMIS : « Instabilité des protéines en présence de plastiques« .
________________________________________
- Contact CEA-IRAMIS : Jean-Philippe Renault (NIMBE/LIONS)
- Contact CEA-JOLIOT : Yves Boulard (I2BC-S/SB2SM/LBSR)
Collaboration :
- M. Schvartz, F. Saudrais, O. Taché, J. Leroy, S. Chédin, L. Pieri, S. Pin, J-P Renault, Université Paris-Saclay, UMR NIMBE CEA-CNRS, France
- F. Saudrais , , K. Rakotozandriny, S. Chédin, Y. Boulard, Université Paris-Saclay, UMR I2BC CEA-CNRS.
- M. Schvartz, G. Brotons, Institut des Molécules et Matériaux du Mans (IMMM), UMR 6283 CNRS, Le Mans Université.
- S. Devineau, Unité de Biologie Fonctionnelle et Adaptative (BFA – UMR 8251 CNRS – Université Paris Cité).
- Frédéric Jamme, Synchrotron Soleil.