En seulement 20 ans, les batteries d'accumulateurs rechargeables lithium-ion se sont imposées sur le marché de l’électronique portable, en particulier grâce à l'amélioration de leurs performances avec l’usage d’anodes de graphite. Le mécanisme de leur activité électrochimique repose sur l’intercalation du lithium entre les plans de graphène auxquels il transfère ses deux électrons. La capacité maximale d’insertion correspond à la formation du composé LiC6, qui équivaut à une capacité théorique de 372 mAh.g-1, encore considérée comme insuffisante pour une application aux véhicules électriques. La recherche de nouveaux matériaux d’anode reste donc très active. L’insertion conjuguée du Li avec un autre métal électropositif (Ca, Eu, …) au sein du graphite permet de dépasser cette stœchiométrie (ex : Li3.0-3.2Ca2.1-2.3C6).
La présente étude montre tout l'intérêt des méthodes de mesures de concentration offertes par la microsonde nucléaire du NIMBE pour étudier l'élaboration de telles électrodes en phase ternaire.
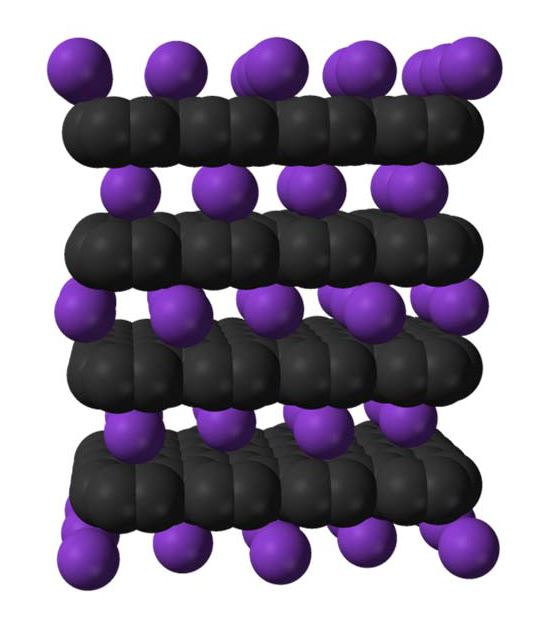
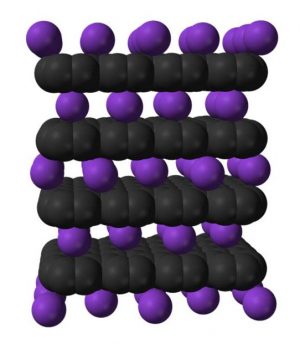
Pour les accumulateurs au lithium les anodes en graphite, au sein duquel le lithium vient s’insérer, font partie des électrodes à faible potentiel d'intercalation, permettant d'éviter la formation de dendrites de lithium, source de court-circuits internes. De telles anodes apportent aussi un bon compromis de performances entre un transport efficace du lithium, une bonne stabilité mécanique pendant les cycles de charge/décharge, une conductivité électrique élevée et un coût réduit. Mais leur capacité reste limitée par la stœchiométrie du composé LiC6 et l'amélioration des performances des accumulateurs Li-ion passe aujourd'hui par la recherche de nouveaux Composés d’Intercalation du Graphite (CIG), qui sont loin d’être tous répertoriés.
Une équipe nancéenne de l’Université Jean Lamour, animée par Claire Hérold, explore actuellement les possibilités d’obtenir de nouveaux CIG ternaires co-insérés, où le graphite est associé à un métal alcalin et un tiers-élément fortement électropositif, ou encore des binaires, où le lithium est cette fois utilisé comme vecteur d’intercalation de l'élément tiers [1].
Réaliser l’intercalation conjointe de deux éléments est difficile. On peut y parvenir en immergeant un bloc de pyrographite dans un alliage fondu à base de lithium contenant également des alcalino-terreux (calcium) ou des terres rares (europium) [2], [3]. Après une mise en contact pouvant aller jusqu’à plusieurs jours, l’échantillon est récupéré pour être analysé par diffraction des rayons X. Pour certaines conditions de synthèse (composition d’alliage, température et durée de réaction), le système LiEuC présente la signature spécifique d’une nouvelle phase ternaire α, associée aux phases binaires connues : LiC6 et EuC6.
Le lithium contribuant très peu à la diffraction, la détermination de l’arrangement structural des composés ternaires formés nécessite la détermination complète et précise de leur composition. Cette mesure est rendue difficile par la présence simultanée des deux éléments légers (le lithium et le carbone), et celle d’hétérogénéités liées à la méthode de synthèse.
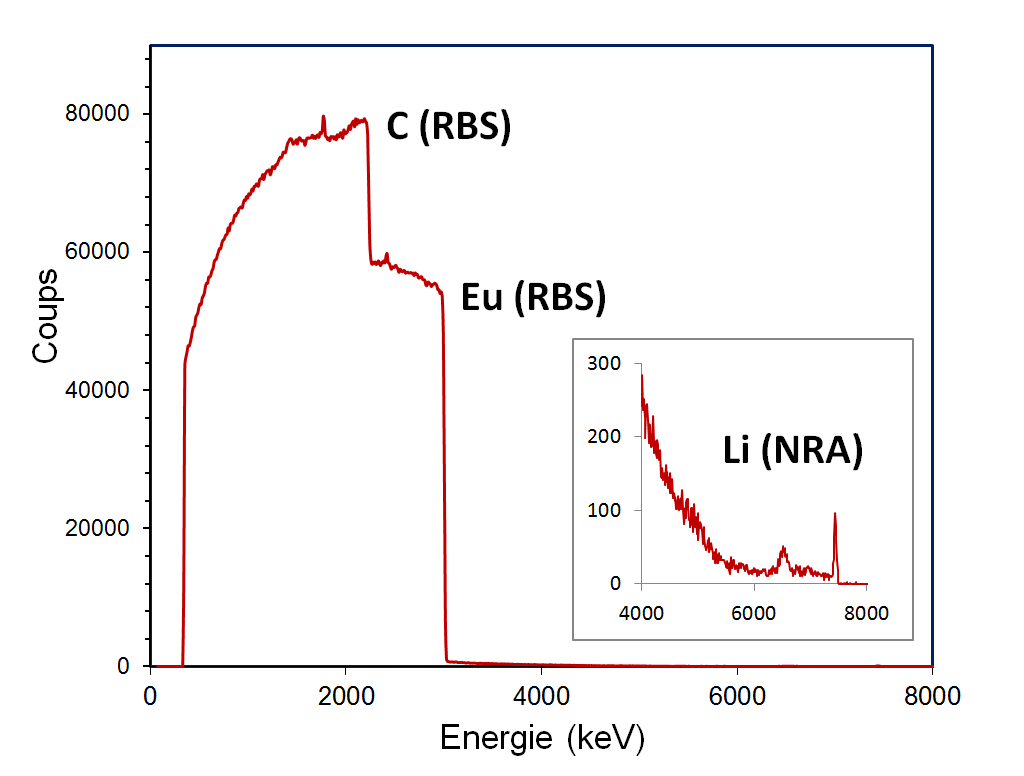
La stœchiométrie de la phase α (Li0.2Eu2C6.) a pu être déterminée pour la première fois, au moyen de la microsonde nucléaire du Laboratoire d’Etude des Eléments Légers (LEEL) du NIMBE (UMR 3685 CEA-CNRS), La microanalyse nucléaire est en effet une des rares méthodes locale qui permet de doser simultanément et de façon absolue tous ces éléments. Comme le montre la figure 1, le spectre des particules produit par un microfaisceau de protons résulte de plusieurs interactions :
- la diffusion élastique, permettant la mesure des concentrations en carbone et europium (méthode RBS, Rutherford Backscattering Spectroscopy),
- les réactions nucléaires donnant accès à la mesure de la concentration en lithium (méthode NRA, Nuclear Reaction Analysis).
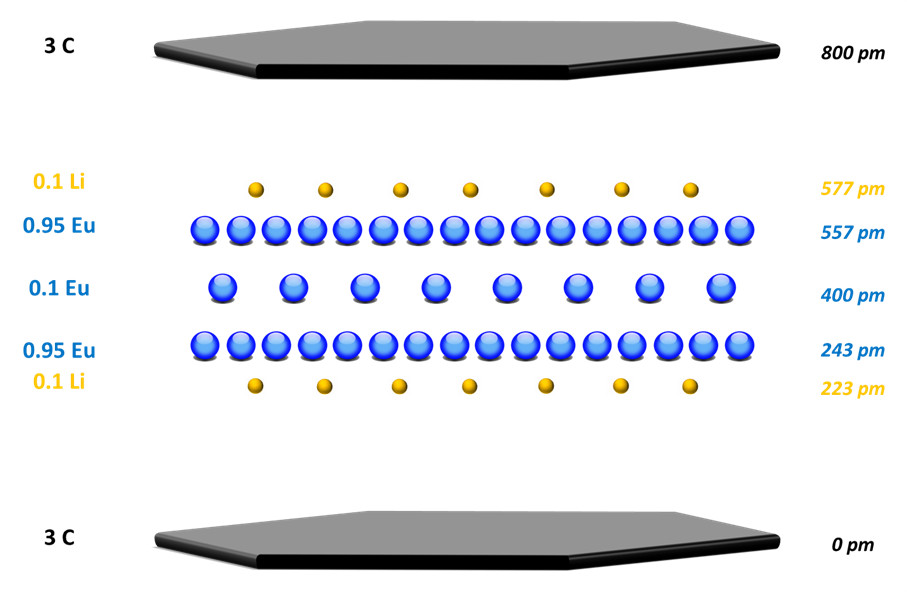
La séquence d’empilement de la phase α a ainsi pu être déterminée à partir de ces mesures de composition et des spectres de diffraction X, complété par la modélisation de la distribution de densité électronique perpendiculairement aux plans. Le résultat donne une structure sous la forme d'une séquence en feuillet de 5 couches, inséré entre deux plans de graphène, comportant trois plans d’europium encadrés par deux plans de lithium.
Cette phase n'est cependant pas la seule. Il est intéressant de noter que l’immersion du pyrographite dans un mélange lithium-europium ne conduit pas systématiquement à la formation de cette phase ternaire, mais peut simplement aboutir à celle du binaire EuC6. La réaction débute toutefois par l’intercalation progressive du lithium. L’étude par diffraction X de la cinétique de formation de EuC6 à partir d’un mélange Li/Eu à 72% en lithium a montre en effet la formation initiale de composés LiC de plus en plus riches en lithium jusqu’à la phase LiC6. Au bout de quelques heures seulement, on observe sa substitution par EuC6 sans passage par une phase ternaire intermédiaire. L’intercalation initiale du lithium, grâce à sa petite taille, prépare celle de l’europium en pré-écartant les plans de graphène. Un cric chimique en quelque sorte…
Ces travaux sont maintenant poursuivis en les transposant à l’intercalation dans des structures de type BCN, apparentées à celle du graphite. Avec la modification partielle du matériau hôte, l’un des objectifs sera d’obtenir des composés aux propriétés intéressantes, supraconductivité et/ou propriétés magnétiques. Des calculs de structure électronique semblent indiquer qu’une teneur élevée en lithium, largement supérieure à celle de LiC6, pourrait être atteinte et conduire à l’obtention de matériaux d’électrode à performances électrochimiques intéressantes
Références :
[2] Recherches sur les composés d’insertion du graphite
A. Hérold Bull. Soc. Chim. Fr., 187 (1955) 999.
[3] Graphite–lithium–europium system: Modulation of the structural and physical properties of the lamellar phases as a consequence of their chemical composition,
S. Cahen, H. Rida, P. Berger, M. Fauchard, P. Lagrange, J.-F. Marêché, C. Hérold, Carbon, 77 (2014) 803.
Contact CEA-IRAMIS : Pascal Berger (NIMBE/LEEL)
Collaboration :
- C. Herold, S. Cahen, H. Rida, M. Fauchard, P. Lagrange, J.-F. Marêché,
Département Chimie et Physique des Solides et des Surfaces (CP2S),
Institut Jean lamour, UMR 7198 CNRS-Université de Lorraine, B.P. 70239, 54506 Vandœuvre-lès-Nancy Cedex, France.
- P. Berger, Laboratoire d’Etude des Eléments Légers (LEEL), IRAMIS/NIMBE – UMR 3685 , CEA Saclay, France.