
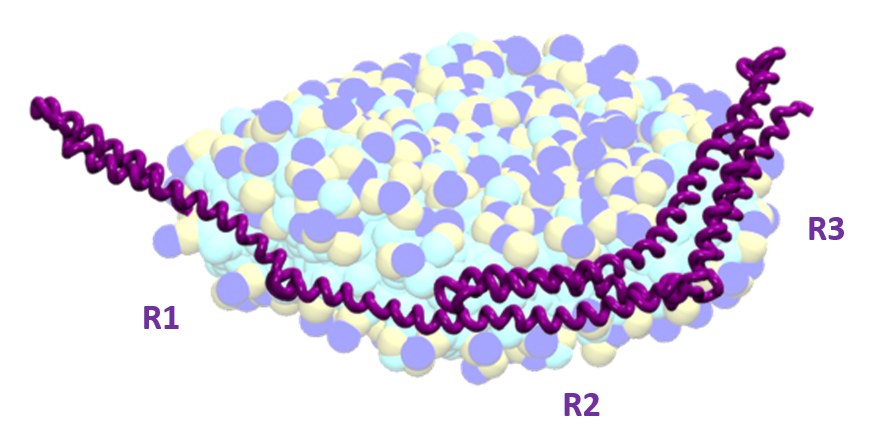
Son travail a porté sur l’étude de la structure de la dystrophine, protéine indispensable à l’activité musculaire (son absence provoque la myopathie de Duchenne), en interaction avec la membrane des cellules musculaires (sarcolemme). En utilisant des bicelles comme modèles de membrane lipidique [1], son travail de thèse montre, en couplant la diffusion de neutrons aux petits angles (SANS) et la modélisation moléculaire, qu’un fragment spécifique de la dystrophine s’ouvre, ce qui permettrait un ancrage de la protéine dans le sarcolemme au cours du processus de contraction/élongation du muscle [2]. Plus récemment, les zones d’interaction entre un autre fragment de la dystrophine et l’actine, une autre protéine clé de la fonction musculaire [3] ont été finement déterminées. R. Dos Santos Morais a effectué un post-doctorat d’un an (2018-2019) au Laboratoire IMoPA, UMR 7365, CNRS-Université de Lorraine, et se trouve actuellement en post-doctorat au Laboratoire d'Ingénierie des Biomolécules (LIBio), EA 4367, Université de Lorraine.
Références :
[1] Dos Santos Morais R, Delalande O, Pérez J, Mouret L, Bondon A, Martel A, Appavou MS, Le Rumeur E, Hubert JF, Combet S. Contrast-matched isotropic bicelles: a versatile tool to specifically probe the solution structure of peripheral membrane proteins using SANS. Langmuir 33: 6572-6580, 2017.
[2] Dos Santos Morais R, Delalande O, Pérez J, Mias-Lucquin D, Lagarrigue M, Martel A, Molza AE, Chéron A, Raguénès-Nicol C, Chenuel T, Bondon A, Appavou MS, Le Rumeur E, Combet S, Hubert JF. Human dystrophin structural changes upon binding to anionic membrane lipid. Biophys J 115: 1231, 2018.
[3] Mias-Lucquin D, Dos Santos Morais R, Chéron A, Lagarrigue M, Winder SJ, Chenuel T, Pérez J, Appavou MS, Martel A, Alviset G, Le Rumeur E, Combet S, Hubert JF, Delalande O. The central domain of dystrophin acts to bridge F-actin to sarcolemmal lipids. J Struct Biology (en révision).




