With the need for an energy transition to avoid the massive CO2 emissions linked to the use of petroleum products, the hydrogen-green energy sector is often put forward. The needs of the chemical industry also require a source of hydrogen that is not derived from fossil carbon products. One way of producing this hydrogen is through the photocatalytic dissociation of water, using solar radiation combined with a photocatalyst.
The study performed by the LEDNA team at NIMBE, in collaboration with ICPEES, shows that the surfaces of oxidized nano-diamonds produced by detonation provide a good photo-catalytic yield of H2 production, equivalent to that obtained with TiO2 nanoparticles, a benchmark in this field.
Une étude réalisée par l’équipe LEDNA du NIMBE, associée au Laboratoire ICPEES, révèle pour la première fois que des nanodiamants (taille ~ 5 nm) synthétisés par détonation, puis oxydés en surface, peuvent sous illumination solaire produire de l’hydrogène, par dissociation photocatalytique de l’eau [1]. Cette production s’effectue sans ajout d’un co-catalyseur, ni formation d’une hétérojonction avec un autre semi-conducteur. Les rendements obtenus sont comparables à ceux des photocatalyseurs nanométriques de référence du domaine, notamment les nanoparticules de TiO2.
Les nanoparticules de diamant possèdent des atouts pour la photocatalyse liés à leur structure électronique : à leurs propriétés semi-conductrices, héritées du diamant massif, s’ajoute la possibilité d’ajuster leur structure de bande, c’est-à-dire la position énergétique des bandes de conduction et de valence, en modifiant la nature des terminaisons de surface (hydrogénées ou oxydées) [2]. Par exemple, lorsque la surface est terminée par des liaisons carbone-hydrogène, la position en énergie de la bande de conduction se situe au-dessus de celle du niveau du vide. Les nanoparticules de diamant hydrogénées constituent alors des sources solides pouvant fournir des électrons solvatés, réducteurs très puissants qui peuvent être utilisés sous illumination UV pour la réduction du CO2 en CO [3] ou la dégradation photocatalytique de composés perfluorés [4].
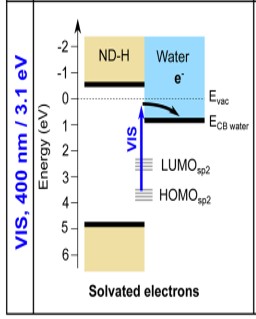
Fig. 1 : Processus d’émission d’électrons solvatés par des nanodiamants hydrogénés [5]. Des états intermédiaires dans le gap, dus aux défauts de surface, permettent l’absorption de lumière visible, et l’hydrogénation de la surface place la bande de conduction au-dessus du niveau du vide.
En jouant sur la nature des nanoparticules de diamant et sur l’introduction de défauts dans leur réseau cristallin ou à leur surface, il est également possible d’augmenter l’absorption lumineuse dans le domaine du spectre visible, comme le montre l’étude récente réalisée en absorption transitoire utilisant des nanodiamants hydrogénés synthétisés au NIMBE [5]. Cette absorption est attribuée à des états énergétiques intermédiaires localisés entre la bande de valence et la bande de conduction du nanodiamant liés à du carbone en hybridation sp2, présent notamment sous forme de reconstructions de type fullerènes en surface (Figure 1).
Ayant ainsi démontré la photo-activité des nanodiamants, la recherche s’est poursuivie en développant la synthèse de nanodiamants dans le but de produire des carburants solaires par photocatalyse, notamment de l’hydrogène à partir de l’eau. Les propriétés de différents types de nanodiamants, ont été explorées selon leur nature : cristallinité, taille, forme, chimie de surface.
Ainsi, l’émission d’hydrogène n’est pas détectée sous illumination solaire pour des nanodiamants hydrogénés ou pour d’autres natures de nanodiamants, tels que ceux obtenus par broyage du diamant massif. Elle se révèle spécifique aux nanodiamants de détonation oxydés. Un rendement maximum de production d’hydrogène de 32 μmol/h a pu être atteint pour une concentration de nanodiamants oxydés de 12,5 μg/mL. Ce rendement est similaire à celui obtenu avec des nanoparticules de TiO2, pour la même concentration de nanoparticules et dans les mêmes conditions d’illumination (Figure 2).
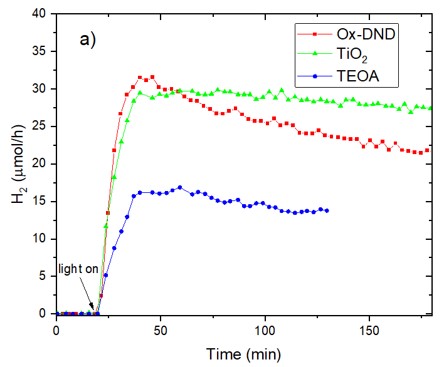
Fig. 2 : Production d’hydrogène en fonction du temps pour des nanodiamants oxydés (carrés rouges) (TEOA : 1 vol.%) comparée à celle de nanoparticules de TiO2 (triangles verts) et de TEOA seul (cercles bleus). Une quantité similaire de 10 mg de nanodiamants oxydés ou de nanoparticules de TiO2, soit une concentration de 12.5 µg mL-1 , ont été respectivement utilisés.
Ce résultat ouvre des perspectives prometteuses concernant l’utilisation du nanodiamant pour la production de carburants solaires. La prochaine étape consiste à l’associer à d’autres matériaux semiconducteurs pour générer des hétérostructures ou à des co-catalyseurs métalliques, afin d’amplifier les performances photocatalytiques observées.
Références :
[1] “Oxidized detonation nanodiamonds act as an efficient metal-free photocatalyst to produce hydrogen by water splitting under solar irradiation”
C. Marchal, L. Saoudi, H. A. Girard, V. Keller and J. C. Arnault, Adv. Energy Sustainability Research 2300260 (2023) 1-8.
Voir aussi :
[2] ” Absolute energy levels in nanodiamonds of different origins and surface chemistries”,
D. Miliaieva, A. S. Djoumessi, J. Cermak, K. Kolarova, M. Schaal, F. Otto, E. Shagieva, O. Romanyuk, J. Pangrac, J. Kulicek, V. Nadazdy, S. Stehlik, A. Kromka, H. Hoppe, B. Rezek, Nanoscale Advances 5 (2023) 4402.
[3] “Selective Photoelectrochemical Reduction of Aqueous CO2 to CO by Solvated Electrons”,
L. Zhang, D. Zhu, G. M. Nathanson, R. J. Hamers, Angew. Chem. Int. Ed. 53 (2014) 9746.
[4] “Degradation of perfluorooctanesulfonate (PFOS) by sub-bandgap irradiation of hydrogen-terminated nanodiamond”,
W. A. Maza, V. M. Breslin, T. I. Feygelson, P. A. DeSario, B. B. Pate, J. C. Owrutsky, A. Epshteyn, Applied Catalysis B: Environmental 325 (2023) 122306.
[5] ” Early dynamics of the emission of solvated electrons from nanodiamonds in water”,
F. Buchner, T. Kirschbaum, A. Venerosy, H. Girard, J. C. Arnault, B. Kiendle, A. Krueger, K. Larsson, A. Bande, T. Petit, C. Merschjann, Nanoscale 14 (2022) 17188.
Contact CEA-IRAMIS : Jean-Charles Arnault et Hugues Girard (NIMBE/LEDNA)
Collaboration :
- C. Marchal et V. Keller, Laboratoire ICPEES, UMR 7515, 25 Rue Becquerel, 67087 Schiltigheim, France.