D. Markovitsi
Laboratoire Francis Perrin, CEA/ DSM/DRECAM/SPAM-CNRS URA 2453 F-91191 Gif-sur-Yvette, France
Tous les médecins nous mettent en garde contre les expositions sans protection au soleil pouvant provoquer coups de soleil, mais aussi à long terme, cancers de la peau. En effet, l'énergie apportée par la lumière déclenche des réactions chimiques, qui sont susceptibles d'entraîner une altération de la chaîne d'ADN, suffisante pour modifier le code génétique. Au-delà de l'identification des réactions pouvant se produire, de leur localisation et de leurs conséquences, il est tout aussi important de comprendre les mécanismes mis en jeu.
Les biologistes ont observés que les lésions créées par ces réactions photochimiques ne sont pas distribuées au hasard le long de la double hélice d'ADN, mais qu'elles sont fonction de la séquence de bases autour de la lésion. Ceci suggère l’existence d’effets coopératifs entre un certain nombre de bases. Pour comprendre cet effet, nous avons étudié en solution des doubles hélices modèles constituées uniquement des paires “adénine (A) – thymine (T)”. Nos expériences montrent que l'absorption d'UV peut (i) peupler des états électroniquement excités délocalisés sur plusieurs bases (excitons), et (ii) induire l’ionisation des doubles hélices d'ADN pour des énergies inférieures à celle nécessaire à l’ionisation des monomères en solution. Il apparaît ainsi clairement que les effets coopératifs entre bases se manifestent dès la toute première étape de l’interaction du rayonnement UV avec l’ADN.
Excitons
Le spectre d’absorption de l’ADN est très proche de celui du mélange de ses constituants (bases en solution). Il en avait été conclu que l'absorption d'un photon UV était un phénomène localisé sur une seule base. Mais ces données spectroscopiques ne donnent pas une signature unique des processus électroniques mis en jeu. Par une modélisation (théorie excitonique) combinant des données de chimie quantique et de dynamique moléculaire (collaboration avec K. Zakrzewska et R. Lavery, CNRS UPR 9080), nous montrons en effet qu‘une délocalisation des états excités ne conduit qu’à de faibles déplacements spectraux. Ce travail théorique remet ainsi en cause l'interprétation usuellement admise, et nous avons ensuite recherché des preuves expérimentales fortes en faveur de l'hypothèse d'une délocalisation de l’excitation.
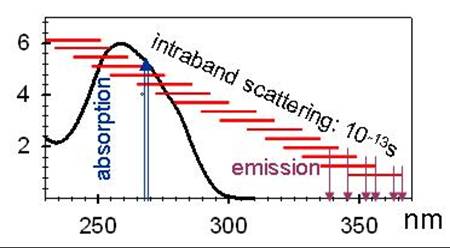
Pour séparer les différents processus électroniques, nous avons sondé la fluorescence des doubles hélices (mesure des dépendances spectrale et temporelle des déclins de fluorescence et d'anisotropie de fluorescence) après excitation par des impulsions laser de 100 femtosecondes (10-13 s). L'ensemble de ces nouvelles mesures et des données existantes peuvent être interprétées dans le cadre de notre modèle où l'excitation UV (4-5 eV) vers un grand nombre d'état délocalisés sur plusieurs bases (excitons) est suivie d’un transfert d’énergie rapide (< 100 fs) par diffusion intra-bande et d'une émission de fluorescence à partir des états situés en bas de la bande excitonique.
Ionisation
Parmi les autres processus photo-chimiques mis en jeu, les réactions d'ionisation sont tout aussi importantes. En solution, la perte d'un électron signant une réaction d'oxydation, la mesure du potentiel d’ionisation des bases de l’ADN est un élément clé pour comprendre, non seulement l'effet du rayonnement UV, mais aussi de différents agents oxydants. Des études théoriques récentes, prévoient un abaissement du potentiel d'ionisation des bases au sein des hélices par rapport aux valeurs déterminées en phase gazeuse. En solution aqueuse, cet effet peut être mis en évidence par des expériences d’absorption transitoire qui permettent de quantifier les électrons solvatés générés et d’identifier les radicaux des bases formés.
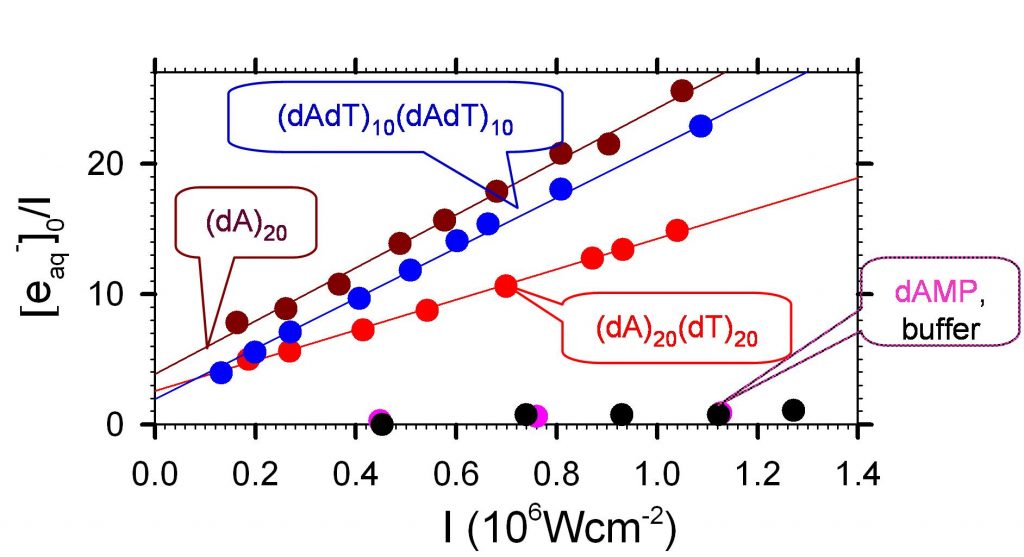
Les quelques expériences de ce type effectuées sur des doubles hélices d'ADN n’avaient pas détecté d’ionisation à un photon à des longueurs d’ondes supérieures à 210 nm (énergie inférieure à 5.9 eV). Nous venons cependant d'observer que des impulsions nanosecondes à 266 nm (4.7 eV) peuvent ioniser à un photon les doubles hélices (dAdT)10(dAdT)10, (dA)20(dT)20. Le rendement de photoionisation de l’ordre de 10-3, est supérieur d’un ordre de grandeur à celui des nucléosides correspondants, ce qui montre, une fois encore, l'importance de l'environnement local de la base ionisée.
Ainsi, ces études photochimiques résolues en temps sur des doubles hélices modèles d'ADN ont permis de mettre en évidence des effets coopératifs entre les bases. La complexité du système impose encore de nombreuses études pour mieux comprendre le lien entre ce
comportement collectif et les dommages de l'ADN.
Publications associées :
1. Complexity of excited state dynamics in DNA,
D. Markovitsi, F. Talbot, T. Gustavsson, D. Onidas, E. Lazzarotto, S. Marguet, Nature,
Brief Communication Arising, Nature 441 E7 (8 June 2006).
2. One and two photon ionization of DNA single and double helices studied by laser flash
photolysis at 266 nm,
S. Marguet, D. Markovitsi, F. Talbot, J. Phys. Chem. B Letter, 2006, 110(23), 11037.
3. Collective behavior of Franck-Condon excited states and energy transfer in DNA double helices
D. Markovitsi, D. Onidas, T. Gustavsson, F. Talbot, E. Lazzarotto,
J. Am. Chem. Soc. Communication 2005, 127, 17130.
4. UV Spectra and Excitation Delocalisation in DNA: Influence of the Spectral Width
E. Emanuele, D. Markovitsi, P. Millié, K. Zakrzewska, ChemPhysChem, 2005, 6, 1387.
22-05-2006



