En biologie et médecine, l’histopathologie est l’évaluation clinique des tissus, pour laquelle la RMN, technique incontournable, permet de déterminer la structure chimique des prélèvements. L’enjeu est ici de trouver une instrumentation et une méthode de RMN pour l’analyse automatisée de la composition métabolique des très petites quantités de matière biologique. La spectroscopie RMN haute résolution en rotation à l’angle magique (HRMAS : High-Resolution Magic Angle Spinning) présente justement l’avantage de permettre l’analyse de très faibles quantités (10 mg) avec une grande sensibilité.
Au-delà de cette technique, les chercheurs du NIMBE ont proposé une méthode de mesure à base de micro-bobines tournantes (MACS : Magic-Angle Coil Spinning) [1], dont le développement a été poursuivi dans 2 directions :
- l’évaluation du potentiel et des limites de la méthode pour l’étude clinique de biopsies
- le développement d’une méthode de micro-fabrication automatisée de résonateurs MACS, indispensable pour la diffusion de la méthode et le contrôle des coûts.

La spectroscopie RMN haute résolution en rotation à l’angle Magique (HRMAS : High-Resolution Magic Angle Spinning) est maintenant reconnue comme un outil de diagnostic clinique de routine permettant de fournir les profils métaboliques de tissus biologiques intacts. Ce profil est visualisé sous la forme d’un spectre, c’est à dire d’une succession de pics représentatifs des espèces chimiques présentes dans l’échantillon.
La méthode HRMAS a un certain nombre d’avantages par rapport à la RMN d’échantillons liquides :
- elle permet l’étude des métabolites sans altération de leur structure et peut offrir des informations sur la mobilité moléculaire,
- elle ne demande pas de préparation spécifique d’échantillons et reste une méthode non destructive,
- elle évite les procédés d’extractions nécessitant de grandes quantités d’échantillon et qui sont souvent sélectifs, car discriminant les métabolites sur la base de leurs solubilités.
- elle élimine les élargissements dus à des couplages dipolaires résiduels, les effets de susceptibilité magnétique, et conduit à des spectres haute-résolution comparables aux spectres d’échantillons liquides isotropes.
Au-delà de cette technique, les chercheurs du NIMBE ont mis au point une méthode de mesure à base de micro-bobines tournantes (MACS : Magic-Angle Coil Spinning) [1,2], dont ils ont étudié l’utilisation dans le cadre d’analyses de biopsies clinique afin d’évaluer le potentiel et les limitations de la méthode. Cette étude montre que ces micro-détecteurs MACS offrent une excellente sensibilité massique et une bonne résolution spectrale pour obtenir des profils métaboliques à partir de biopsies de quelques nanolitres. Bien que la résolution spectrale de la méthode standard HRMAS (largeur de raie <1 Hz sur les spectres conventionnels) reste meilleure que celle de la méthode MACS (largeur de raie ~ 3 Hz), les spectres obtenus (MACS) présentent la résolution suffisante pour l’identification des métabolites [3].
Technologiquement, une méthode de micro-fabrication automatisée de résonateurs MACS à l’aide d’une bobineuse numérique a été mise au point. Un condensateur est tout d’abord fabriqué par lithographie sur un support plat. Le capillaire devant contenir l’échantillon, est micro-fabriqué en résine photosensible SU-8 sur ce support. On soude ensuite sur ce même support, un fil d’or de quelques microns de diamètre qui est ensuite enroulé à l’aide de la bobineuse autour du capillaire, puis soudé sur l’autre électrode du condensateur. La procédure est très rapide (quelques millisecondes !) et reproductible. Sous réserve de pouvoir utiliser un fil conducteur moins onéreux, l’objectif d’une fabrication massive de micro-bobines jetables, indispensables aux applications biologiques, est ainsi envisageable. Les bobines ainsi fabriquées ont été testées et donnent des résultats très encourageants [4].

Du point de vue biologique, la méthode de référence aujourd’hui dans l’évaluation clinique des tissus est l’histopathologie. Lorsque la quantité de tissu obtenu à partir d’une seule biopsie est limitée, les 10 mg d’échantillon requis pour effectuer une analyse par RMN régulière HR-MAS, peuvent être difficile à obtenir, et un choix s’impose alors entre l’analyse RMN et les évaluations histopathologiques conventionnelles. Ainsi la méthode MACS par la quantité bien plus faible de tissu nécessaire (de l’ordre du microgramme) permet d’éviter de tels compromis.
Un autre domaine où la méthode MACS pourra aussi être utile est l’étude de simples petits organismes. Par exemple, les premiers stades de la drosophile larve et Caenorhabditis Elegans (petit ver vivant dans les sols) sont des organismes de taille submillimétriques qui peuvent être individuellement facilement installé à l’intérieur d’une micro-bobine MACS. Une unique mesure en spectroscopie RMN HR-MAS, nécessite de grandes quantités (plusiers milliers d’individus) de C. Elegans, tandis que la mesure sur un individu unique par la méthode MACS est possible.
Enfin, une autre application possible de la méthode MACS peut être l’étude de cellules uniques in vitro. Ainsi, dans les cultures de cellules souches, l’étude HR-MAS de cellules intactes peut être difficile, parce que nécessitant 30 µl de cellules. L’obtention d’une telle quantité implique le risque d’inclure un certain pourcentage de cellules spontanément différenciées.
Ainsi les détecteurs tournants MACS présentent de nombreux avantages qui doit leur permettre de tenir un rôle important en métabolomique par RMN de micro-biopsies, surtout s’ils peuvent être micro-fabriqués à moindre coût, avec une grande précision et reproductibilité.
Références :
[1] D. Sakellariou, G. Le Goff et J.-F. Jacquinot, “High resolution, high sensitivity NMR of nanoliter anisotropic samples by coil spinning”, Nature, 447 (2007) 694.
Voir l’article associé CEA-Techno n° 90 : « Haute résolution pour très petits échantillons« .
[2] A. Wong, P. Aguiar, D. Sakellariou, « Slow magic-angle coil spinning: A high sensitivity and high-resolution NMR strategy for microscopic biological specimens », Magn. Reson. Med., 63 (2010) 269.
[3] A. Wong, B. Jimenez, X. Li, E. Holmes, J. Nicholson, J. Lindon and D. Sakellariou, « Evaluation of High Resolution Magic-Angle Coil Spinning NMR Spectroscopy for Metabolic Profiling of Nanoliter Tissue Biopsies », Analytical Chemistry, 84 (2012) 3843.
[4] V. Badilita, B. Fassbender, K. Kratt, A. Wong, C. Bonhomme, D. Sakellariou, J. G. Korvink and U. Wallrabe, « Microfabricated inserts for magic angle coil spinning (MACS) wireless NMR spectroscopy », PLoS ONE 7 (2012) e42848.
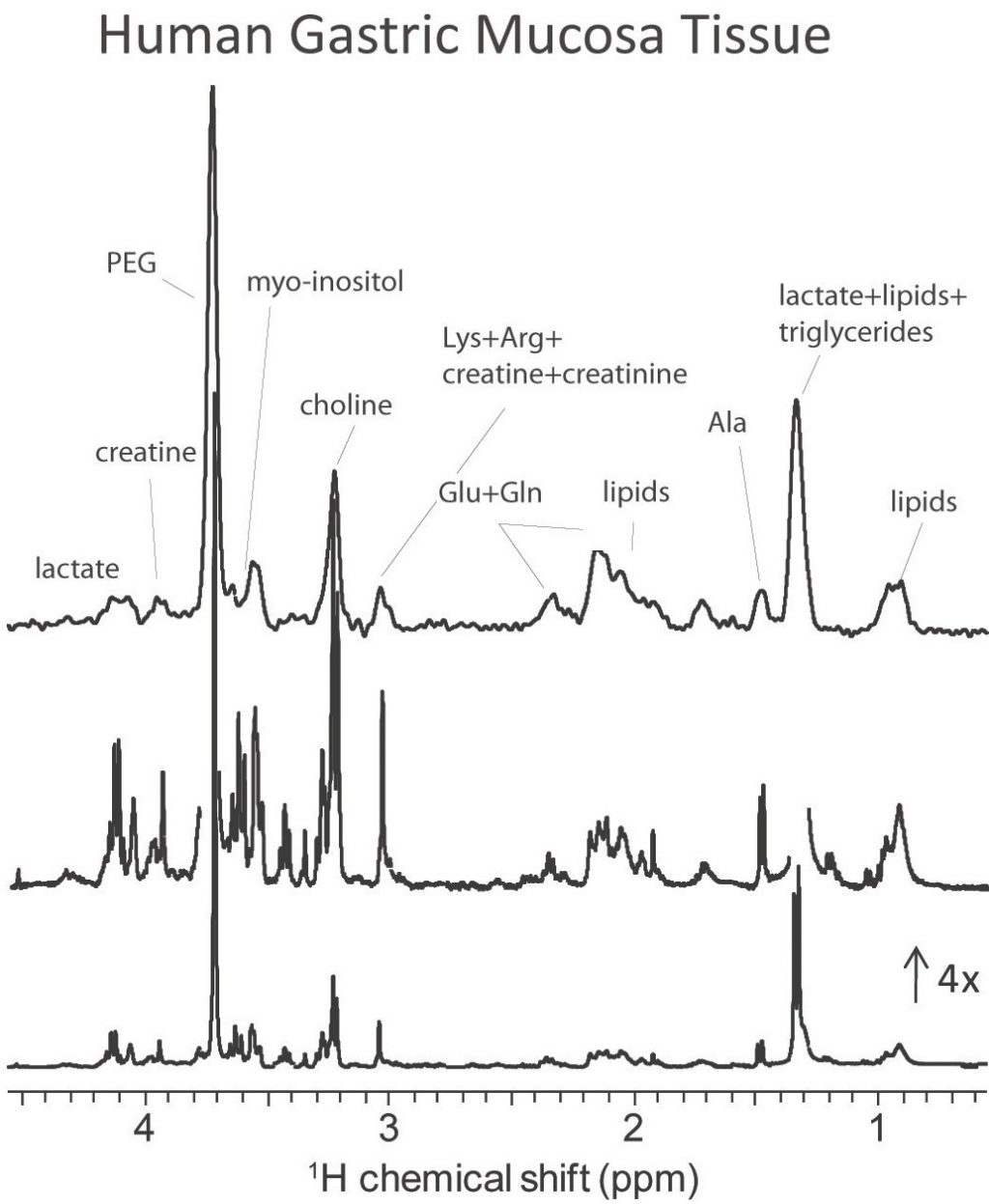
Spectres RMN HRMAS et HRMACS de 1H sur un échantillon de tissus de muqueuse gastrique humaine. Les pics correspondent à différents métabolites, qui ne sont visibles que lorsqu’on fait tourner l’échantillon à l’angle magique. 500 nanogrammes d’échantillons ont été mesurés et le gain en sensibilité est d’un facteur 7, par rapport à une mesure standard par la méthode HRMAS avec un détecteur de 4 mm. Bien que la résolution de HRMACS ne soit pas encore ultime, notre étude montre qu’elle est suffisante pour des études cliniques.
Ces résultats ont été obtenus dans le cadre de collaboration entre les laboratoires :
- Laboratoire de Structure et Dynamique par Résonance Magnétique, CEA / IRAMIS / NIMBE
- Division of Biomolecular Medicine, Department of Surgery and Cancer, Faculty of Medicine, Imperial College London, SW7 2AZ, London, United Kingdom
- Department of Microsystems Engineering (IMTEK), Albert Ludwigs University Freiburg, Freiburg, Germany
|
Le projet a été financé par : – l’ERC sous le contrat Starting grant #205119, attribué à D. Sakellariou, – C’Nano sous le contrat NanoMACS porté par C. Bonhomme (Chimie de la matière condensée de Paris – UMR 7574) et D. Sakellariou, Ce projet vient de recevoir un financement ANR Jeune Chercheur pour A. Wong. |
   |
Contact CEA : Dimitrios Sakellariou (IRAMIS/NIMBE/LSDRM).




