Les plastiques, légers et peu onéreux, sont souvent préférés comme matériaux de contenant pour les produits alimentaires, ménagers ou de pharmacie. Une recherche active reste de mise pour garantir que le plastique choisi est bien inerte vis-à-vis du contenu et ne détériorera pas ses qualités. Ceci est d'autant plus important pour les produits pharmaceutiques, contenant des protéines qui peuvent plus facilement se dégrader.
L'étude menée par deux équipes du NIMBE et de l'I2BC au CEA, associés à l'INRAE et l'IMMM, montre que les protéines solubilisées peuvent être déstabilisées par contact avec les parois du flacon, conduisant, du fait de l'agitation, à la formation d'agrégats protéiques à l'interface avec l'air, puis en en solution. Le plastique est le matériau le plus défavorable, comparé au verre ou au téflon.
L'étude se poursuit avec l'étude du rôle joué par la présence de microplastique dans les milieux biologiques.

La déstabilisation et l'agrégation des protéines dans les produits biothérapeutiques (en particulier les nouveaux anticorps monoclonaux à visée thérapeutique ou de diagnostic) peut réduire leur activité et leur efficacité. Elle peut également favoriser des réactions immunitaires responsables d'effets indésirables graves. L’impact des modes de flaconnage et de transport sur la déstabilisation des protéines n'est pas totalement compris et une recherche active sur ce sujet doit être menée.
Les équipes de l'I2BC et du NIMBE au CEA, associés à l'IMMM et l'INRAE, ont donc allié leurs compétences pour étudier de façon approfondie [1] les rôles de la surface du matériau du flacon, de l'interface air/liquide et de l'agitation du produit contenu, afin de décrypter leurs effets respectifs dans la déstabilisation et l'agrégation des protéines. L'effet des surfaces en polypropylène, téflon et verre sur la stabilité de protéines purifiées (sérum-albumine bovine, hémoglobine et α-synucléine) et sur un extrait cellulaire complexe composé de 6000 protéines solubles ont ainsi été caractérisés, dans des conditions d’agitation douce et contrôlée.
Les observations combinent le suivi des pertes en protéine (avec un dosage par spectroscopie UV-visible et micro-spectroscopie Raman), couplé à des mesures de diffusion dynamique de la lumière (par analyse de « speckle » laser) et de protéomique (étude du protéome, ensemble des protéines contenues dans le système, par spectrométrie de masse). L'étude montre que les matériaux des flacons, en particulier les plastiques, jouent un rôle initiateur dans la déstabilisation des protéines qu’ils contiennent, à l’image de ce qui a été observé précédemment par les mêmes équipes sur la silice [2].
Cet ensemble de mesures a permis également de proposer un modèle mécanistique de déstabilisation des protéines (voir figure 1) : les protéines sont déstabilisées au contact de la surface du flacon, et exhibent alors une fonction hydrophobe. Sous l'effet de l’agitation, elles migrent alors à l’interface air-eau, où elles vont se compacter pour réduire la longueur d'interface avec le liquide, sous la forme d’agrégats protéiques de taille micronique (voir figure 2). Enfin, toujours dues à l'agitation, les forces de cisaillement en surface libèrent ces agrégats qui se retrouvent alors en solution. Une portion de surface redevient alors libre pour permettre l'agrégation de nouvelles protéines déstabilisées. In fine la solution devient fortement contaminée par ces agrégats de protéines dégradées qui ont perdu leur fonctionnalité.
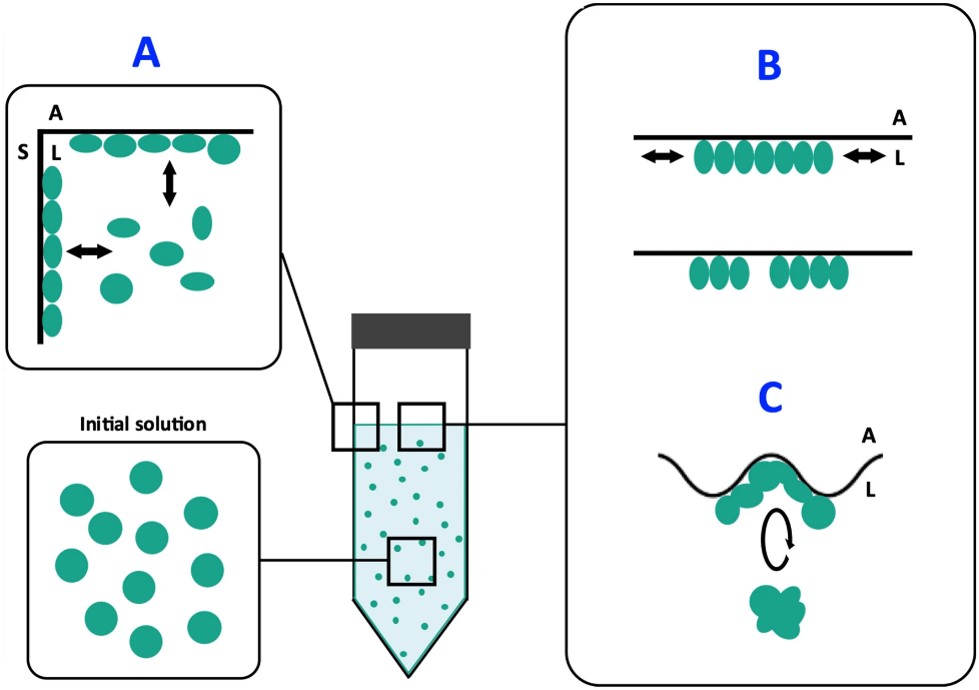
(A) Les protéines en solution sont déstabilisées au contact de la paroi du flacon.
(B) Les protéines, exhibant alors un caractère hydrophobe, migrent et s'adsorbent à l'interface air-liquide, où l’agitation induit des forces de compression et de décompression favorisant leur agrégation.
(C) La déformation de l'interface sous l'effet de l’agitation induit des forces de cisaillement qui peuvent rompre les films protéiques formés à l'étape B, facilitant ainsi le transfert des agrégats en solution, avec un possible retour à l'étape A.
Le mécanisme est suffisamment fort pour amener à la dégradation de protéines par ailleurs très robustes comme l’hémoglobine. Ce sont cependant les assemblages protéiques de grandes tailles (plusieurs dizaines de nanomètres) qui sont les plus sensibles, probablement en raisons d’effets capillaires et de pression de surface à l’interface air-eau.
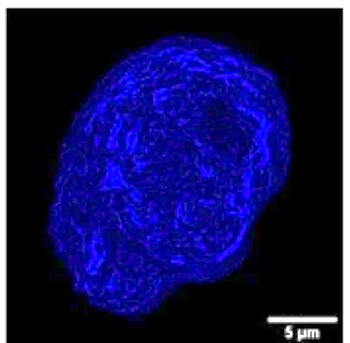
L'étude montre que le polypropylène est le matériau le plus défavorable vis-à-vis de la dégradation des protéines. Le téflon est moins réactif, mais plus onéreux. À noter cependant que même si le flacon n'induit une faible dégradation, la petite quantité de protéine dégradée peut suffire à déclencher une réaction immunitaire indésirable. Une attention particulière doit donc être accordée au conditionnement des produits protéiques, plus particulièrement pour les nouvelles thérapies à base d'anticorps monoclonaux.
Ces observations, et le modèle mécanistique proposé, fournissent également des indications sur la manière de minimiser ces effets : en réduisant, voire supprimant, l'une des composantes du stress – le matériau du contenant, l'air (même partiellement) ou l'agitation – les protéines seront mieux préservées. Les équipes poursuivent leurs recherches par l'étude de l'impact de la présence de microplastiques, pouvant être dispersées en milieu biologique, sur les biomolécules.
Références :
[1] “A proteome scale study reveals how plastic surfaces and agitation promote protein aggregation”
M. Schvartz, F. Saudrais, S. Devineau, J-C Aude, S. Chédin, C. Henry, A. Millán-Oropeza, T. Perrault, L. Pieri, S. Pin, Y. Boulard, G. Brotons & J-P Renault. Scientific Reports 13 (2023) 1227.
[2] « In situ analysis of weakly bound proteins reveals molecular basis of soft corona formation »
D. Sanchez-Guzman, G. Giraudon–Colas, L. Marichal, Y. Boulard, F. Wien, J. Degrouard, A. Baeza-Squiban, S. Pin, J-P Renault, and S. Devineau, ACS Nano 14(7) (2020) 9073–9088.
Voir aussi :
- La couronne de protéines adsorbées sur des nanoparticules de silice dévoile sa structure (sur le site de l'Institut Joliot).
- De l’importance de la taille des protéines dans les interactions protéines-nanoparticules (sur le site de l'Institut Joliot)
Contacts :
- CEA-IRAMIS : Jean-Philippe Renault (NIMBE/LIONS)
- CEA-JOLIOT : Yves Boulard (I2BC-S/SB2SM/LBSR)
Collaboration :
- M. Schvartz, F. Saudrais, S. Chédin, L. Pieri, S. Pin, J-P Renault, Université Paris-Saclay, UMR NIMBE CEA-CNRS, France
- F. Saudrais , J-C Aude, S. Chédin, L. Pieri, Y. Boulard, Université Paris-Saclay, UMR I2BC CEA-CNRS.
- M. Schvartz, T. Perrault, G. Brotons, Institut des Molécules et Matériaux du Mans (IMMM), UMR 6283 CNRS, Le Mans Université.
- C. Henry, A. Millán-Oropeza, Université Paris-Saclay, INRAE, AgroParisTech, Micalis Institute, Plateforme d’Analyse Protéomique de Paris Sud Ouest (PAPPSO).
- S. Devineau, Unité de Biologie Fonctionnelle et Adaptative (BFA – UMR 8251 CNRS – Université Paris Cité).





