P. Viswanath, J. Daillant, L. Belloni, M. Alba, DRECAM/SCM – Service de Chimie Moléculaire
S. Mora (LCVN, Montpellier) et O. Konovalov (ESRF)
Fiche fait marquant au format PDF
Dissoudre du sel (NaCl) dans l’eau n’est pas anodin. En solution, le sodium et les chlore se séparent sous forme ionique Na+ et Cl–, s’entourent de molécules d’eau et se dispersent. Ceci modifie profondément la nature du solvant qui devient ainsi, par exemple, bon conducteur. Au niveau de la surface, la distribution des ions reste cependant encore très mal connue, bien que de nombreuses propriétés « de contact » en dépendent.
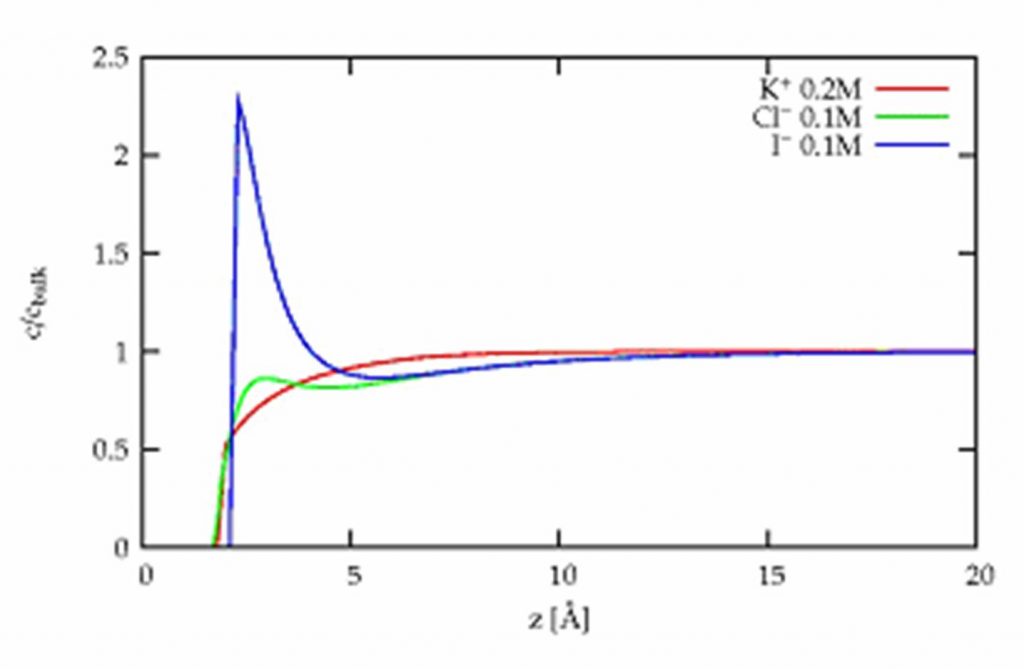
En étudiant des solutions de mélange de sels par fluorescence X sous incidence rasante à l’ESRF (synchrotron de Grenoble), il a été possible de déterminer précisément leur composition en surface. La comparaison de solutions pures et de mélanges de sels est ici essentielle car elle a permis de bien identifier et mesurer les interactions à très courte portée. Les interactions coulombiennes entre ions de même charge restant identiques, seules ces interactions sont responsables des différences observées. On observe alors que les iodures sont plus attirés par la surface que les bromures qui le sont plus que les chlorures. Plus quantitativement, les mesures des profils de concentration (Fig.1) peuvent être reproduites par un modèle simple de sphères ioniques dans un solvant continu, en ajoutant aux interactions coulombienne (les ions de charge opposées s’attirent) et de dispersion (le solvant tend à disperser les ions), une interaction à courte portée [2].
Références :
[1] F. Hofmeister, “Zur Lehre von der Wirkung der Salze II”, Arch. Exp. Pathol. Pharmakol. 25 p. 247 (1888)
[2] W. Kunz, L. Belloni, O. Bernard and B. Ninham « Osmotic coefficients and surface tensions of aqueous electrolyte solutions: Role of dispersion forces », Journal of Physical Chemistry B 108 (2004) 2398.
[3] P. Jungwirth and D. Tobias « Molecular structure of salt solutions: A new view of the interface with implications heterogeneous atmospheric chemistry », Journal of Physical Chemistry B 105 (2001) 10468.
Publication associée :
Specific Ion Adsorption and Short-Range Interactions at the Air Aqueous Solution InterfaceV. Padmanabhan, J. Daillant, L. Belloni, Serge Mora, M. Alba, O. Konovalov
Phys. Rev. Lett. 99, 086105 (2007)
((i) lysozyme : protéine que l’on rencontre dans les larmes, la salive, le blanc d’œuf…