Le rôle régulateur de la protéine Hfq, protéine bactérienne notamment trouvée chez Escherichia coli, est attribué principalement à sa fonction d'ARN-chaperon, facilitant les interactions entre ARNs. La protéine est aussi impliquée dans la structuration et la compaction de l’ADN.
Une large collaboration internationale a étudié par diverses techniques d'imagerie et de spectroscopie, en particulier sur synchrotron, les complexes formés par la protéine amyloïde Hfq et l'ADN simple brin. Il est ainsi montré que la protéine Hfq peut jouer un rôle dans la recombinaison génétique et la réplication.
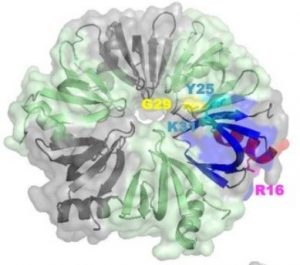
La protéine Hfq est un régulateur bactérien qui intervient dans de nombreux aspects du métabolisme des acides nucléiques (ARN et ADN), ce qui lui confère de nombreux rôles physiologiques importants. Parmi ces multiples fonctions, elle est essentielle à la réplication du bactériophage Qβ, virus à ARN à brin unique à polarité positive, qui infecte les bactéries comme Escherichia coli, bactérie commune de la flore intestinale. La protéine Hfq régule aussi l'efficacité de la traduction des ARNm et aide à compacter l'ADN double brin au sein des cellules bactériennes. Mais ces fonctions demandent à être mieux explorées et précisées, en particulier les modes d'interaction pouvant unir la protéine Hfq et l'ADN (simple ou double brins).
Deux études précédentes, ont montré que la protéine Hfq :
- forme des structures amyloïdes, comme celles retrouvées lors de maladies neuro-dégénératives, et que ces structures affectent l’intégrité de la membrane bactérienne.
- est impliquée dans le contrôle de l'écoulement d'une solution d'ADN. C'est en particulier la région amyloïde de la protéine Hfq (région C-terminale, permettant son agrégation en plaque amyloïde) qui est impliquée dans la réponse mécanique du fluide complexe, formant un solide « mou » inhomogène.
Ces premiers résultats ont été suivis par une nouvelle étude structurale, qui montre pour la première fois que la région amyloïde de Hfq modifie radicalement la structure de l'ADN monobrin en formant une hélice parallèle, ce qui provoque l'alignement du complexe Hfq:ADN.
Pour obtenir ce résultat une combinaison de méthodologies expérimentales comprenant de la spectroscopie (dichroïsme circulaire et linéaire sur synchrotron, infrarouge) et de l'imagerie moléculaire (fluorescence et microscopie électronique) a été utilisée pour sonder les interactions entre Hfq et l'ADN simple brin et les complexes nucléoprotéiques formés.
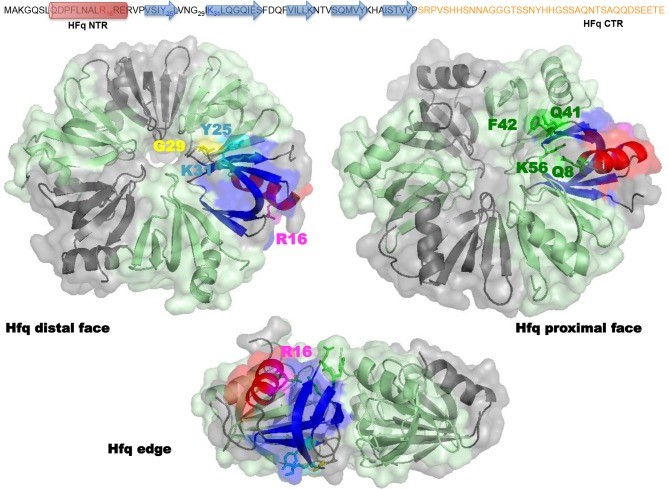
L'action de la protéine Hfq sur l'ADN mise en évidence peut alors avoir des implications importantes pour la réplication et la recombinaison de l'ADN in vivo.
Les protéines Hfq fixant l’ADN simple brin peuvent alors jouer un rôle crucial dans de nombreux processus biologiques fondamentaux, y compris la réplication de l'ADN et la recombinaison génétique. Hfq apparait aussi comme un acteur important à considérer dans la structure des chromosomes bactériens et le contrôle de l'expression des gènes La mise en évidence de l'implication de ces protéines amyloïdes dans la recombinaison génétique dévoile un nouveau mode de régulation possible de la réplication et de la recombinaison, pouvant se produire dans toutes les cellules vivantes.
Référence :
Amyloid-like Hfq interaction with single stranded DNA: involvement in recombination and replication in Escherichia coli,
Krzysztof Kubiak, Frank Wien, Indresh Yadav, Nykola C. Jones, Søren Vrønning Hoffmann, Eric Le Cam, Antoine Cossa, Frederic Geinguenaud, Johan R. C. van der Maarel, Grzegorz Węgrzyn et Véronique Arluison, Quarterly-Reviews-of-Biophysics Discovery, CUP (2022).
- Actualité 2020 : « L’interaction entre une protéine amyloïde bactérienne et l’ADN induit une réponse viscoélastique« .
- Actualité 2017 : « Amyloïdes fonctionnels et adaptation bactérienne« .
Contact CEA : Véronique Arluison (LLB/MMB).
Collaboration :
- Université Paris-Saclay, Laboratoire Léon Brillouin UMR CEA-CNRS , LLB/MMB
- DISCO Beamline, Synchrotron SOLEIL
- Synchrotron ISA (Aarhus Danemark) et Department of Physics and Astronomy, Aarhus University
- Plateforme CNanoMat and Inserm, U1148, Laboratory for Vascular Translational Science, UFR SMBH, Université Paris 13, Sorbonne Paris Cité, Université de Bobigny
- Department of Molecular Biology, Université de Gdansk (Pologne),
- Department of Physics, National University of Singapore
- Genome Integrity and Cancer, Institut Gustave Roussy
- Institut Curie, PSL University, Université Paris-Saclay, CNRS UMS2016, Inserm US43, Multimodal Imaging Centre.