Les batteries rechargeables au lithium-oxygène(Li-O2) ou au lithium-air sont des alternatives possibles aux batteries lithium-ion pour le stockage de l’énergie. Elles offrent une énergie spécifique théoriquement élevée de l’ordre de ~3500 Wh kg-1, plus de dix fois supérieure à celle des batteries Li-ion actuelles. Cependant, les batteries Li-O2 sont loin d’être au point et n’ont pas encore atteint leur plein potentiel de fonctionnement, principalement en raison de leur nombre limité de cycles de charge-décharge. Une meilleure connaissance du fonctionnement de ce type de batterie est donc nécessaire pour en améliorer les performances.
Les études Operando, qui consistent à acquérir des données analytiques sur une batterie en fonctionnement, sont essentielles pour obtenir une vision claire des mécanismes de réaction en jeu. Cependant, l’adaptation de ces techniques à une batterie métal-oxygène est un défi, car elle nécessite un apport continu d’oxygène. Une équipe de l’IRAMIS a donc conçu une cellule avec un réservoir d’oxygène gazeux, permettant à une cellule Li-O2 de fonctionner à l’intérieur de l’aimant de résonance magnétique nucléaire (RMN) pendant l’acquisition du spectre. Les résultats détaillent les mécanismes électrochimiques et de dégradation d’une pile Li-O2 opérationnelle.
Les batteries métal-oxygène(M-O2) ont suscité beaucoup d’intérêt ces dernières années, car elles offrent la densité énergétique la plus élevée. La batterie lithium-oxygène offre théoriquement une énergie spécifique d’environ 3500 Wh kg-1 à l’état déchargé, avec la combinaison du lithium, un métal léger, et de l’oxygène, naturellement abondant dans l’atmosphère, comme matériaux actifs.
Pendant la décharge d’une batterie Li-O2, une réaction électrochimique entre les ions Li et l’oxygène O2 conduit à la formation de peroxyde de lithium Li2O2. Cependant, les performances des batteries Li-O2 restent assez médiocres, en raison de réactions chimiques parasites pendant la charge impliquant des solutions électrolytiques, de l’oxygène singulet, du Li2O2 et des électrodes de carbone, conduisant à la formation des composésCO2, Li2CO3, du formiate de lithium (HCOOLi) et de l’acétate de lithium(CH3COOLi). Les études in situ ont fourni des informations initiales précieuses sur la chimie en temps réel des batteries Li-O2
Pour sa part, la résonance magnétique nucléaire (RMN) peut fournir des informations essentielles sur les mécanismes en jeu, notamment sur la formation et le comportement des produits amorphes. Jusqu’à présent, cependant, la RMN n’a été appliquée qu’ex situ, après le fonctionnement et le démontage de la cellule. Ces mesures ne donnent pas nécessairement une vision réaliste de la cellule et peuvent conduire à des données biaisées et à des interprétations erronées, notamment en raison de la forte réactivité des produits formés dans les batteries Li-O2, tels que l’oxygène singulet et le peroxyde. Les premiers développements de la RMN opératique ont été principalement appliqués aux batteries Li-métal ou métal-ion basées sur l’intercalation ou l’insertion de l’ion porteur de charge. Cela n’avait pas encore été réalisé pour les batteries Li-O2, en raison de la difficulté d’incorporer une électrode à gaz O2 dans le dispositif RMN.
L’équipe NIMBE/IRAMIS a réussi à concevoir un système fermé (voir figure ci-dessous) avec une cellule cylindrique à double compartiment, dont l’un sert de réservoir d’oxygène et l’autre abrite la pile d’électrodes. Le premier avantage de ce système fermé est qu’il peut être facilement manipulé pendant les expériences de RMN, sans connexion à une alimentation en gaz. Un autre avantage important de cet arrangement, pour le type de batterie à étudier, est l’absence d’évaporation de l’électrolyte par le flux de gaz. Lors de la conception de la cellule, d’autres impératifs ont également été pris en compte pour permettre les mesures RMN :
- géométrie de la cellule adaptée à l’espace disponible à l’intérieur de la tête de la sonde RMN.
- absence de matériaux métalliques pour éviter toute interaction avec le puissant champ magnétique ;
- une étanchéité robuste et une bonne pression mécanique à l’intérieur de la cellule pour assurer la cyclabilité et la durabilité de la batterie ;
- une masse suffisante de matériau d’électrode pour améliorer la sensibilité des mesures.
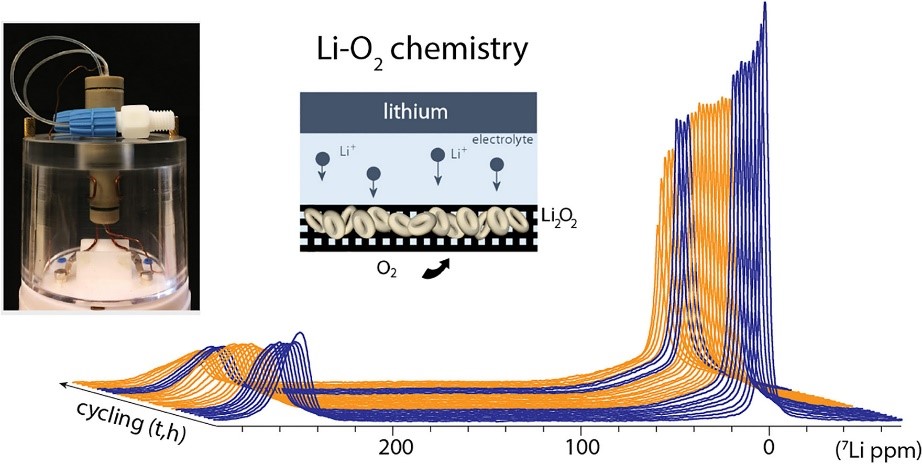
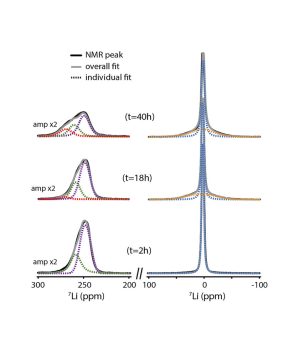
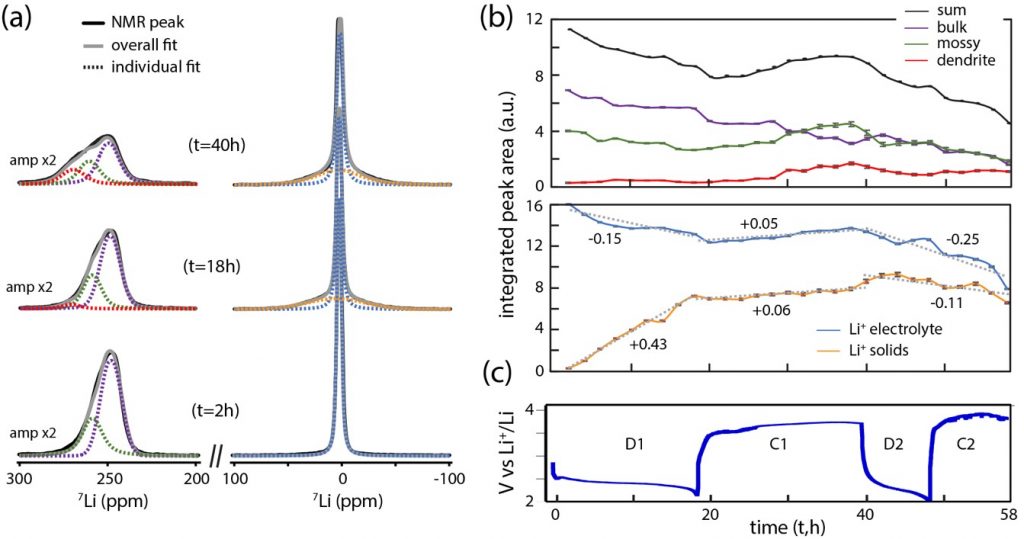
Après avoir vérifié la qualité du processus chimique dans la cellule Li-O2 nouvellement conçue, l’équipe a observé son fonctionnement avec une cathode en carbone à l’aide de la 7LiNMR(voir la figure ci-dessous). Les mesures operando fournissent des informations à la fois sur l’anode de lithium (voir figure ci-dessous, en suivant le pic à gauche, qui a un déplacement chimique de l’ordre de ~ 250 ppm) et sur l’évolution de l’électrolyte et de la cathode (en suivant le pic avec un déplacement chimique très faible, ~ 4 ppm). Pendant la décharge, une chute de la concentration en lithium métal est observée, ainsi qu’une contribution des ions diamagnétiques Li lents. Ceci est principalement attribué à la formation du produit de décharge Li2O2 attendu.
Pendant la charge, le lithium métal est redéposé sur l’anode, principalement sous forme de lithium « mousseux » et de dendrites, mais sans revenir au niveau initial. Ainsi, le lithium échangé pour former du Li2O2 pendant la décharge ne retourne pas de manière réversible à l’anode pendant la charge. L’oxydation de Li2O2 en Li et O2 n’est donc pas complète, et une partie du Li est consommée dans des processus parasites. Ceci est en accord avec l’évolution de la résonance RMN de la phase solide pendant la charge (pic de droite, déplacement chimique ~ 4 ppm, pour t=40h), suggérant que des produits irréversibles et parasites ont également été formés, tels que Li2CO3 et l’acétate de Li, ce qui explique le faible rendement de la cellule.
Ces expériences de RMN operando mettent en évidence les défis et les obstacles des batteries Li-air, tels que la réactivité élevée des produits de décharge et de l’électrolyte, qui empêchent pour l’instant la commercialisation de cette technologie.
Outre la batterie Li-O2, cette étude ouvre la voie à l’analyse RMN opérative d’autres batteries métal-oxygène telles que Na-O2, Al-O2 ou Zn-O2, ou de tout dispositif électrochimique nécessitant une entrée de gaz. Ainsi, la conception de la cellule RMN pourrait être adaptée à l’étude des piles à combustible, si un flux continu de combustibles et d’oxydants est assuré dans la cellule elle-même.
Références
Z. Liang, Q. Zou, Y. Wang, Y.-C. Lu, Small Methods 1 (2017) 1700150.
[2 ]« Operando NMR characterization of a metal-air battery using a double-compartment cell design. »
M. Gauthier, M. H. Nguyen, L. Blondeau, E. Foy, A. Wong, Solid State Nuclear Magnetic Resonance 113 (2021) 101731.
________________________________________
Contact CEA-IRAMIS : Alan Wong(NIMBE/LSDRM) ; Magali Gauthier (NIMBE/LEEL).