Spectroscopies laser et applications
Contacts : E. Gloaguen, M. Mons
|
|
La spectroscopie laser de double résonance IR/UV menée en phase gazeuse (jet supersonique et désorption laser) couplée à une modélisation par chimie quantique permet une analyse conformationnelle poussée des systèmes étudiés et des interactions intramoléculaires qui les stabilisent. |
Acides aminés neutres en phase gazeuse
Contacts E. Gloaguen, M. Mons
Le caractère peu polaire des acides aminés neutres comme la Glycine, l’Alanine ou encore la Phénylalanine conduit la chaine peptidique, lorsqu’elle est isolée dans le vide, à adopter des conformations de repliement correspondant à un environnement hydrophobe, assez proche de celui de l’intérieur d’une protéine, comme les coudes β ou les brins β.
En revanche les acides aminés polaires neutres Sérine, Cystéine, Histidine ou encore Asparagine permettent à leur chaine latérale d’établir des interactions spécifiques avec les liaisons peptidiques voisines leur conférant à ces aminoacides des propriétés uniques en termes de liaisons hydrogène. Nous avons caractérisé ces liaisons H en phase gazeuse, c’est-à-dire en absence de solvant, et montré qu’elles sont omniprésentes dans les protéines, où elles participent à la stabilisation des structures secondaires.
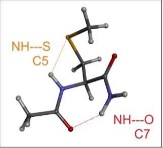
Briques élémentaires de foldamères en phase gazeuse
Contacts M. Mons, V. Brenner
Cette thématique capitalise sur les acquis de l’équipe et notamment son rôle pionnier dans la spectroscopie laser des peptides isolés. Les briques élémentaires de foldamères, basées sur des β-peptides, plus complexes que les peptides naturels, présentent des interactions intramoléculaires spécifiques, qui sont caractérisables par spectroscopie laser IR/UV. Ces études sont à l’origine du projet ANR TUNIFOLDS, en collaboration avec les groupes de D. Aitken et A. Zehnacker à Orsay, qui cherche à faire de ces interactions intramoléculaires, et plus particulièrement des liaisons hydrogène NH – S, impliquant un hétéroatome soufre inclus dans la brique élémentaire, un pivot susceptible de contrôler finement le repliement des oligomères de ces briques élémentaires, pour former divers types de structures secondaires (hélices, rubans, etc…).
Ce projet est financé par l'Agence Nationale de la Recherche (2017-2020, ANR-17-CE29-0008)
Collaborations :
• Pr. David J. Aitken (Institut de Chimie Moléculaire et des Matériaux d'Orsay, Université Paris-Saclay)
• Anne Zehnacker, Katia LeBarbu-Debus, Valéria Lepère, (Institut des Sciences Moléculaires d'Orsay, Université Paris-Saclay)