Dès le début de la découverte de la radioactivité, les chercheurs se sont intéressés aux effets chimiques provoqués par les rayonnements. Malgré la faiblesse des sources radioactives de l'époque qui rendait les expériences quantitatives pratiquement impossibles, on a trouvé que l'eau irradiée par les rayons a du radium se décomposait en formant de l'hydrogène et de l'oxygène. Un peu plus tard, il fut montré que ce phénomène de radiolyse de l'eau donnait lieu aussi à la formation d'eau oxygénée H2O2. Avant la guerre de 1914, le français Debierne avait déjà reconnu que la décomposition de l'eau par les rayons a impliquait la formation d'espèces instables. Un grand pas a été accompli par les chimistes du projet Manhattan qui ont montré que l'eau se décomposait avec formation de radicaux libres H et OH, mais ce travail est resté classé pendant plusieurs années. Un des phénomènes les plus déroutants était qu'en présence d'hydrogène la décomposition de l'eau était inhibée alors qu'elle augmentait en présence d'oxygène ou d'eau oxygénée.
L'explication de ce comportement paradoxal, spécifique de l'eau, a été donnée par Allen qui a montré que H2 et H2O2 se recombinaient sous rayonnement grâce aux radicaux H et OH. Le mécanisme, bien que complexe (il fait intervenir en particulier une réaction chimique en chaîne), rend parfaitement compte des résultats expérimentaux.
L'étude détaillée du mécanisme de l'action de l'hydrogène conduisait A.O. Allen à suggérer en 1958 que l'atome H n'était pas l'espèce principale formée par la radiolyse de l'eau. Cette hypothèse fut confirmée quelques années plus tard par la découverte de l'électron hydraté par E.J. Hart et J.W. Boag. Cette espèce chimique originale, notée eaq, peut être décrite comme un électron entouré de molécules d'eau. Elle est stabilisée par l'attraction entre la charge de l'électron et les moments dipolaires électriques des molécules d'eau. Sa chimie est maintenant bien connue.
La radiolyse de l'eau dans les réacteurs nucléaires.
Dans le circuit primaire des réacteurs nucléaires exploités par l'Electricité de France, l'eau portée à une température de 300°C sert à la fois de modérateur et de fluide caloporteur. Elle est soumise à un rayonnement intense constitué de neutrons et de rayons g dus à la réaction de fission de l'uranium. La réaction nucléaire en chaîne est contrôlée grâce à la propriété du bore 10 d'absorber les neutrons thermiques :
10B + n ® 7Li + 4He + photon g
L'énergie cinétique de 7Li et de 4He (2,2 MeV) contribue aussi à la radiolyse de l'eau. Pour éviter la corrosion du circuit primaire, il est nécessaire de limiter au maximum la formation d'oxygène ou d'eau oxygénée par radiolyse. Pour cela, on ajoute dans l'eau préalablement désoxygénée un peu d'hydrogène. Cet hydrogène qui n'est pas consommé aide à recombiner comme on l'a vu plus haut les produits de la radiolyse en eau. Les études menées dans le cadre d'une collaboration entre DSM, DRN et DTA ont pour objet de mieux connaître ce mécanisme de l'action de l'hydrogène qui, malgré son apparente simplicité, implique une trentaine de réactions chimiques.
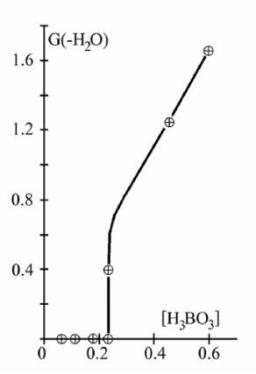
Figure 2 : Décomposition de l’eau à 30°C pour une puissance de 70 KW en fonction de la concentration en acide borique.
Un problème similaire se pose pour le futur réacteur de fusion thermonucléaire contrôlée. Le programme ITER relatif à ce projet associe l'Europe, le Canada, la CEI, les Etats-Unis et le Japon. L'eau servant au refroidissement de la première paroi faisant face au plasma sera soumise à un rayonnement dix fois plus intense que dans les réacteurs de fission. Les études menées à l'IRAMIS/SCM dans le cadre du projet ITER ont pour but de déterminer si l'on pourra également inhiber la radiolyse de l'eau en ajoutant de l'hydrogène.
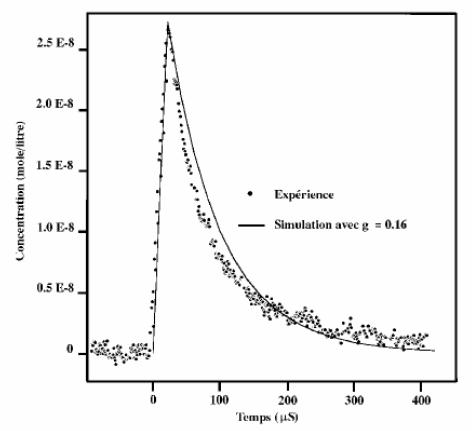
Un aspect remarquable révélé par ces études est que l'inhibition de la radiolyse de l'eau par addition d'hydrogène est un phénomène à seuil qui dépend de la concentration de l'hydrogène, de la température de l'eau, de la nature du rayonnement et de la présence éventuelle d'impuretés chimiques (produits de corrosion). Une très faible modification de l'un de ces paramètres lorsqu'on est proche du seuil peut faire brutalement basculer la radiolyse de l'eau. Un exemple est montré dans la figure 2 où est observé la décomposition de l'eau en fonction de la concentration d'acide borique. Au delà d'une certaine concentration, on observe soudainement la décomposition de l'eau avec formation d'hydrogène, d'oxygène et d'eau oxygénée. Ce phénomène brutal est dû à l'empoisonnement de la réaction en chaîne recombinant H2 et H2O2. Dans certains cas, on observe un phénomène de saturation : lorsque les concentrations de O2 et H2O2 augmentent trop, la réaction en chaîne s'arrête. Cette saturation fut confirmée par des simulations sur ordinateur.
Ainsi, la connaissance de la variation du seuil en fonction des différents paramètres permettra la modélisation du système complexe des réactions chimiques intervenant dans la radiolyse. Cette modélisation a pour objet d'éviter qu'un réacteur de fission ou de fusion ne se trouve dans une situation d'équilibre instable vis-à-vis de la radiolyse avec formation d'oxygène et d'eau oxygénée qui conduisent à une corrosion accrue du circuit de refroidissement ainsi qu'à une augmentation de la radioactivité de l'eau.
LA RADIOLYSE PULSEE
|
|
La durée de vie des radicaux provenant de la radiolyse de l'eau n'excède pas quelques microsecondes. Pour pouvoir identifier ces radicaux en temps réel et déterminer leurs vitesses de réaction avec des composés chimiques, il est nécessaire d'utiliser une technique spécifique : la radiolyse pulsée.
La source de rayonnement utilisée est en général un accélérateur d'électrons portant leur énergie cinétique à quelques méga-électrons-volts. Les électrons sont émis par paquets au cours d'impulsions dont la durée est comprise entre 10 nanosecondes et 1 microseconde. La variation de la concentration des radicaux au cours du temps est mesurée par une méthode optique. Car chaque radical peut être identifié par son spectre d'absorption dans le domaine visible ultra-violet ou proche infra-rouge.