La diffusion des macromolécules dans les cellules ne suit généralement pas des lois simples de diffusion du fait de la grande quantité et diversité de molécules présentes dans ce milieu. Les globules rouges présentent un cas particulier de cellules composées quasi-exclusivement d’une seule protéine presque sphérique : l’hémoglobine, reconnue depuis longtemps comme augmentant par sa diffusion le transport d’oxygène à travers une solution.
L'objectif de notre étude a été d’essayer de comprendre si la diffusion de l’hémoglobine au sein du globule rouge modifie la cinétique de capture d’oxygène par la cellule. Cette diffusion a été mesurée en solution pour plusieurs concentrations, par spectrométrie à écho de spin de neutrons. Par cette technique on observe que cette diffusion reste brownienne jusqu’à des concentrations physiologiques, et reste similaire pour une même concentration, au sein des globules rouges et en solution. Il est enfin remarquable de constater que la concentration en hémoglobine dans les globules rouges correspond à un optimum du transport d’oxygène.
Alors que la diffusion des protéines en solutions diluées peut être décrite de manière remarquable à partir d'un mouvement brownien, elle est supposée s'éloigner de ce modèle simple dans les différents compartiments cellulaires. L’origine de comportement « anormal » n’est pas clairement établie, mais pourrait être attribuée à l’encombrement cytoplasmique, où la présence de macromolécules de différentes formes et tailles se déplaçant librement (protéines, ribosomes, ARN …), ainsi que la présence de réseaux de filaments fixes seraient responsables du fort ralentissement de la diffusion des protéines. On observe aussi une variation du déplacement carré moyen des protéines non linéaire avec le temps, mais en loi de puissance (comportement sous-diffusif).
Les globules rouges sont des cellules particulières en ce sens qu’elles ne contiennent quasiment qu’une sorte de protéine : l’hémoglobine (Hb), molécule tetramérique de 64 kDa, de forme presque sphérique. Cette molécule joue un rôle central dans le transport de l'oxygène au sein de la plupart des organismes. L'objectif de la présente étude [1] est de mesurer l’évolution de la diffusion de l’hémoglobine en solution, en fonction de sa concentration. Pour ceci, la diffusion de neutrons à écho de spin permet, par la mesure de la « fonction intermédiaire » de diffusion des neutrons (domaine temporel), de distinguer le caractère anormal ou brownien de la diffusion d’une molécule. Dans le cas présent, on observe par cette technique que, quel que soit la concentration en protéines dans la solution, cette fonction intermédiaire de diffusion reste une exponentielle simple avec une variation en vecteur d'onde du temps de relaxation en accord avec une diffusion brownienne.
Même aux concentrations les plus élevées (330-350 g/L) la diffusion de l’hémoglobine ne présente donc pas de caractère anormal. La comparaison avec des mesures similaires directement dans les globules rouges [2], met en évidence la similitude de la diffusion de l’hémoglobine au sein d'une cellule (in vivo) et en solution (in-vitro).
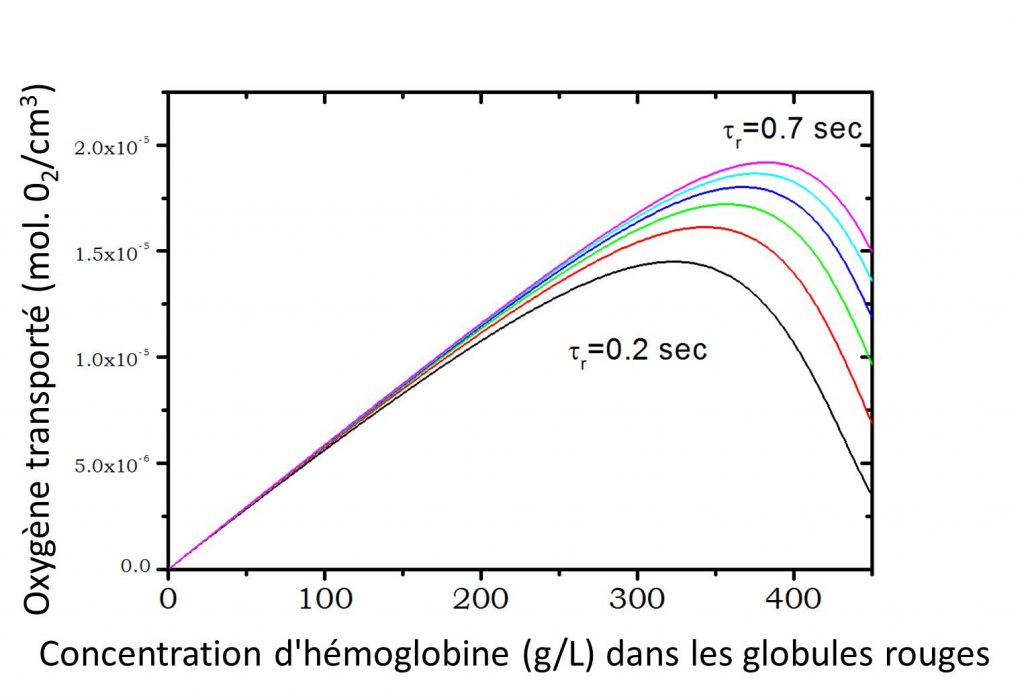
Sur le plan physiologique, la capture de l’oxygène par les globules rouges dans les poumons est un mécanisme complexe qui doit s’opérer durant le temps limité, appelé temps de contact (ou de transit), où le sang passe dans les capillaires pulmonaires et est en contact avec les alvéoles. Ce temps, fonction du niveau d’activité physique de la personne, est typiquement compris entre τ = 0.7 s pour une personne au repos et τ = 0.2 s pour une personne en activité physique intense. Par ailleurs, Clark et al. [3], ont estimé le temps de capture de l’oxygène par le globule rouge, à partir des constantes cinétiques de capture de l’oxygène par l’hémoglobine, ainsi que des coefficients de diffusion de l’oxygène et de l’hémoglobine. Durant cette période les molécules d’hémoglobine doivent se charger en oxygène à raison de 4 molécules par protéine. La capacité de transport d’oxygène des globules rouges est ainsi directement liée à leur concentration en hémoglobine. Mais à forte concentration la mobilité (ie : diffusion) des protéines diminue.
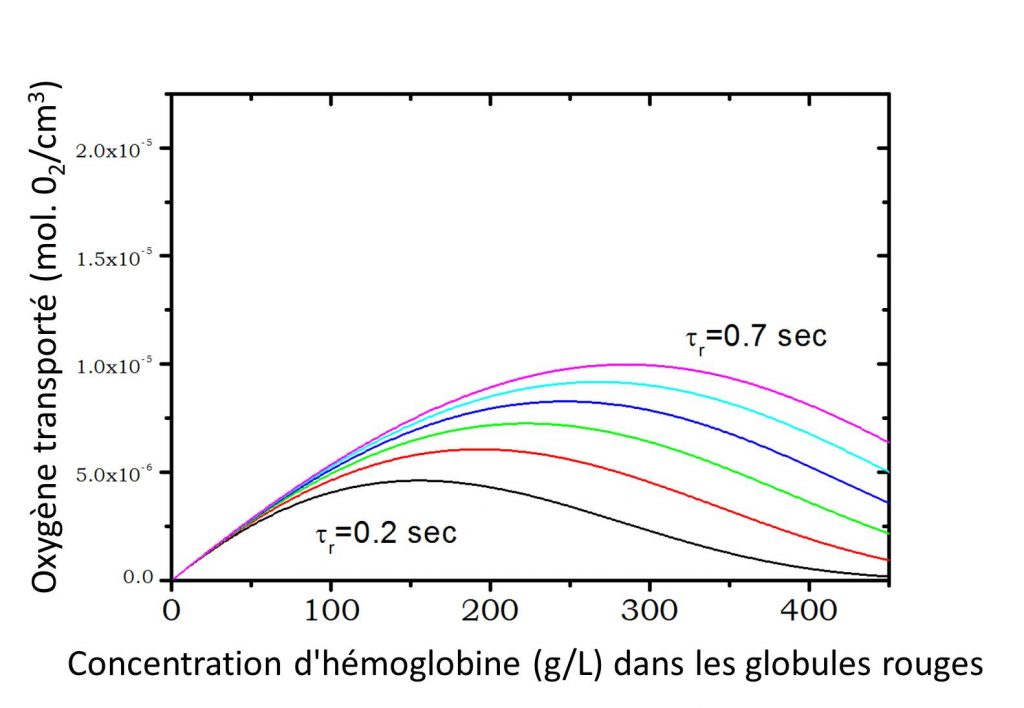
À partir de ce modèle, et en prenant en compte le temps limité pour effectuer la capture d’oxygène dans les alvéoles, il est possible d'estimer la quantité d’oxygène transportée par un globule rouge pour différents temps de contact τ. Deux cas limites peuvent être considérés : i- l’hémoglobine est considérée comme fixe dans la cellule ; son coefficient de diffusion est nul (figure ci-dessus) ou ii- l’hémoglobine diffuse dans la cellule selon les valeurs mesurées par écho de spin (figure ci-contre). Dans les deux cas, la quantité d’oxygène transportée en fonction de la concentration en protéines présente un maximum avant de s'atténuer à forte concentration. Dans le cadre de ce modèle, on observe clairement que la diffusion de l’hémoglobine permet d’augmenter la quantité d’oxygène transportée dans le globule rouge et que la concentration physiologique en hémoglobine dans le globule rouge (330 g/L) correspond à l'optimum de transport d’oxygène pour un individu en forte activité physique (τ = 0.2 s).
Cette étude suggère donc que la nature a su optimiser la concentration d'hémoglobine présente dans les globules rouges du sang pour obtenir le transport d'oxygène le plus efficace possible au cours d'un effort intense, ceci apportant sans doute un avantage sélectif dans une sélection darwinienne.
Références :
[1] « Hemoglobin diffusion and the dynamics of oxygen capture by red blood cells »
S. Longeville and L.-R. Stingaciu, Scientific Report, 7, 10448 (2017)
[2] « Microscopic diffusion and hydrodynamic interactions of hemoglobin in red blood cells »
W. Doster and S. Longeville, Biophysical J., 93, 1360 (2007)
[3] « Oxygen delivery from red cells »
A. Clark, W. J. Federspiel, P. A. Clark and G. R. Cokelet, Biophys. J., 47, 171 (1985).
Contact CEA : Stéphane Longeville (LLB).
Collaboration :
- Laboratoire Léon Brillouin (LLB – UMR 12 CEA-CNRS)
- L.-R. Stingaciu, Jülich Centre for Neutron Science, outstation at SNS, Oak Ridge National Laboratory, Oak Ridge, TN, 37831, USA.