Les liquides ioniques sont des électrolytes composés exclusivement de cations et d’anions organiques en interaction. Leurs remarquables stabilités chimique et électrochimique en font d’excellents candidats pour le développement de systèmes de stockage d’énergie, devant répondre à des critères stricts quant au risque de combustion.
En tant que liquides purs, ils présentent des propriétés physico-chimiques originales, liées à leur structure locale sous la forme d’agrégats transitoires de taille nanométrique, qui résulte de la compétition entre interactions électrostatiques et forces de van der Walls. Une analyse fine de l’auto-diffusion des cations , mesurée aux différentes échelles, entre le niveau moléculaire jusqu'à l’échelle mésoscopique, par diffusion de neutrons ou de lumière et RMN, montre que ce phénomène d’auto-association des espèces ioniques de charge opposées est un facteur limitant de la conductivité électrochimique.
Il est ensuite montré que la frustration de la formation des agrégats par confinement nanométrique unidimensionnel est alors une voie prometteuse pour apporter aux liquides ioniques des propriétés de conductions, qui se révèlent compétitives en comparaison avec des électrolytes moins stables.
Les Liquides Ioniques (LI) sont des électrolytes liquides constitués à température ambiante d’anions et de cations organiques. Ces systèmes suscitent actuellement un double intérêt : tout d’abord en termes technologiques, dans le domaine des équipements de stockage électrochimique de l’énergie, puisque leur grande stabilité chimique et électrochimique permettrait de répondre à des préoccupations majeures quant à la sureté pyrotechnique des batteries. Ils soulèvent également des questions de nature tout à fait fondamentale, car un vif débat très actuel vise à définir leur nature physico-chimique exacte, entre électrolytes forts (où les entités ioniques sont fortement dissociés) ou faibles (faiblement dissociés).
En première approche et en absence de tout co-solvant, l'observation à l'échelle atomique ou moléculaire (par microscopie à sonde locale et mesure de Force de Surface – AFM-SFA, par exemple), montre une forte corrélation entre entités de charges opposées. L'appariement local d’anions et de cations conduit ainsi à la formation (transitoire) d’entités électriquement neutres qui, étant assimilables à un solvant non chargé, diminuent fortement la concentration effective des charges, ce qui est caractéristique d'un électrolyte faible [1]. A l'opposé à grande échelle, les mesures de conductivité ionique montrent une forte mobilité des charges indépendantes, ce qui est caractéristique du comportement dynamique d'un électrolyte fort [2].
Une clef permettant de résoudre la controverse, entre la vision statique locale et dynamique à grande échelle, consiste à sonder le déplacement des charges de l’échelle moléculaire (nanométrique), jusqu’à l’échelle macroscopique (quelques micromètres). À ce jour, aucune technique ne permet une telle mesure multi-échelle directe. Cependant, la conductivité électrique étant contrôlée par la mobilité des charges (relation de Nernst-Einstein), la simple mesure des processus d'autodiffusion des espèces apporte les informations nécessaires. Les techniques de diffusion de neutrons (étude par temps de vol de Diffusion de Neutrons Quasi-Élastique – QENS et expériences de Spin-Echo-NSE) sont des méthodes de choix pour ce type de mesures multi-échelle de l’échelle très locale (ps et échelle atomique) à l’échelle de quelques dizaines de nanomètres et de nanosecondes. La dépendance en fonction du vecteur de diffusion (Q) des temps de corrélation permet en outre de s’assurer que les processus sondés sont bien de nature diffusionnelles. Au-delà, pour atteindre les échelles supérieures au micromètre et à la milliseconde, la RMN à gradient de champs peut prendre le relais (Voir figure ci-dessous- a). Deux liquides ioniques usuels à base imidazolium complémentaires avec une forte propension à l’auto-structuration ont ainsi été étudiés en couplant l'ensemble de ces méthodes : le 1-octyl-3-methylimidazolium tétrafluoroborate (OMIM-BF4, qui présente une forte nano-structuration[3]) et le 1-butyl-3-methyl imidazolium bis(trifluoro-methanesulfonyl imide (BMIM-TFSI, à nano-structuration modérée [4] ).
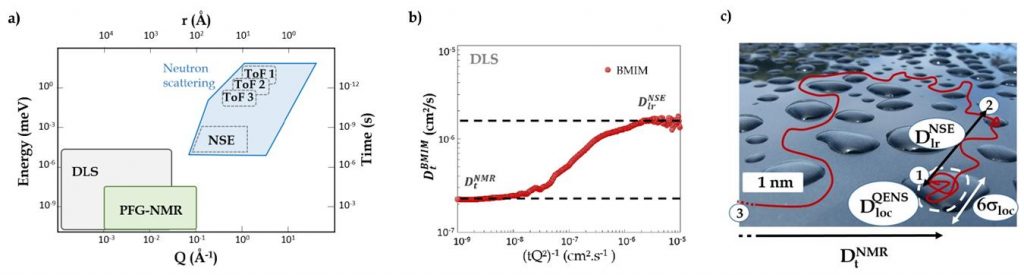
b) Malgré une différence d’un ordre de grandeur entre les deux grandeurs, une expérience de rhéologie par DLS (courbe rouge) permet de relier le fort coefficient d'auto-diffusion (1.6 x 10-6 cm2/s) des cations du liquide ionique, mesurés à l’échelle moléculaire par diffusion de neutron et la mesure bien plus faible (2.7 10-7 cm2/s) mesurée à l’échelle mésoscopique par PFG-RMN. c) Vue d’artiste du processus de diffusion à grande échelle, limité par la présence d'agrégats nanométriques transitoires dans le liquide.
Les deux techniques neutrons et RMN, permettent de sonder les processus diffusionnels des cations via la dynamique moyenne de leurs protons. On constate une différence de deux ordres de grandeur entre les coefficients de diffusion mesurés à l’échelle moléculaire et mésoscopique. Une expérience de rhéologie à base de traceurs nanométriques dispersés au sein du LI et suivi par Diffusion Dynamique de la Lumière (DLS) confirme cet écart (b) qui est du à la présence d'agrégats nanométriques (c) au sein du liquide. Cette observation est un élément important qui clarifie le débat sur la nature exacte des liquides ioniques.
Ils suggèrent de plus que la frustration de la formation de la nano-structuration des LI par confinement unidimensionnel [5] est une voie prometteuse pour accroitre significativement la conductivité de ces systèmes. Ainsi, le coefficient d'autodiffusion au sein d'un liquide ionique confiné dans des membranes de nanotubes alignés, est augmenté d'un facteur 3 par rapport au liquide libre. Une bonne piste pour concevoir des membranes séparatrices et électrodes pour batterie de haute puissance [5, 6 ].
Références :
[1] « Are room-temperature ionic liquids dilute electrolytes? »
A. A. Lee, D. Vella, S. Perkin and A. Goriel, J. Phys. Chem. Lett., 6 (2015) 159
[2] « Ionic liquids behave as dilute electrolyte solutions »
M. A. Gebbie, M. Valtiner, X. Banquy, E. T. Fox, W. A. Henderson and J. N. Israelachvili, PNAS, 110 (2013) 9674.
[3] “Nanostructuration of Ionic Liquids: impact on the cation mobility. A multi-scale study”
F. Ferdeghini, Q. Berrod, J. -M. Zanotti, P. Judeinstein, V. Garcia Sakai, O. Czakkel, P. Fouquet and D. Constantin, Nanoscale, 9, 1901 (2017)
[4] « Ionic Liquids: evidence of the viscosity scale-dependence »
Q. Berrod, F. Ferdeghini, J.-M. Zanotti, P. Judeinstein, D. Lairez, V. García Sakai, O. Czakkel, P. Fouquet and D. Constantin, Scientific Reports, 7, 2241 (2017)
[5] « Enhanced ionic liquid mobility induced by confinement in 1D CNT membranes »
Q. Berrod, F. Ferdeghini, P. Judeinstein, N. Genevaz, R. Ramos, A. Fournier, J. Dijon, J. Ollivier, S. Rols, D. Yu and J.-M. Zanotti, Nanoscale, 8, 7845 (2016).
[6] « Voir aussi le fait marquant : » Des accumulateurs Li-ion à la puissance décuplée à base de nanotubes de carbone ? « .
Contact CEA-IRAMIS : Jean-Marc Zanotti (LLB)
Collaborations :
- Victoria García Sakai, ISIS Neutron and Muon Facility, RAL, Chilton, Didcot, OX11 0QX, UK
- Orsolya Czakkel and Peter Fouquet, Institut Laue Langevin, Grenoble, France.
- Doru Constantin, Laboratoire de Physique des Solides, CNRS, Université Paris-Sud, Université Paris-Saclay, Orsay, France