Le transport et la distribution de médicaments dans l’organisme sont des mécanismes complexes régis par de nombreux processus différents. Un rôle important est joué par les protéines de transport, responsables de la fixation et la libération des médicaments. Améliorer la compréhension des facteurs qui contrôlent la structure et la dynamique de complexes médicament-protéine est aujourd’hui devenu un enjeu majeur.
Nous rapportons ici une étude récente [1] de l'interaction entre le flurbiprofène (FBP), un médicament anti-inflammatoire non-stéroïdien chiral, et l'albumine sérique humaine (HSA).
HSA est la protéine de transport la plus abondante dans le sang. Elle contient un tryptophane (Trp), acide aminé qui absorbe et émet dans l'UV comme le FBP. Ce tryptophane peut également interagir avec FBP après la photo-excitation via transfert d’énergie ou d’électron.
Compte tenu de la complexité du système FBP-HSA, deux dyades modèles (dénommées (S,S) et (R,S)), formées par le (S)- ou le (R)-FBP et le (S)-TrpMe (l’ester méthylique) liés de manière covalente, ont été synthétisées pour l'étude des processus primaires impliqués dans l'interaction FBP-Trp.
Pour étudier la dynamique de cette interaction, nous avons utilisé une combinaison de deux techniques de fluorescence résolue en temps; la génération de somme des fréquences, avec une résolution temporelle de ~100 femtosecondes, et le comptage du photon unique, avec une résolution temporelle de ~25 ps. En particulier, l’évolution temporelle de la fluorescence aux temps courts informe sur les interactions hors équilibre qui se produisent entre le médicament photo-excité et la protéine, ce qui peut apporter des informations précieuses sur la dynamique structurelle de l'ensemble.
Des mesures de spectroscopie stationnaire sur les dyades ont mis en évidence une inhibition important de fluorescence (> 90%) et que la faible émission résiduelle est due au résidu TrpMe. Cela a été pris comme une indication d’un transfert d'énergie FBP -> TrpMe. Une nouvelle bande, déplacée vers le rouge, (centré à 450 nm), a également été observée et attribuée à une émission de type « exciplex ».
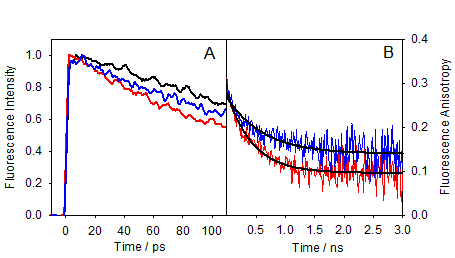
Nos mesures de fluorescence résolue en temps (Figure 1) montrent que les déclins de fluorescence des dyades sont beaucoup plus rapides que ceux de du FBP ou TrpMe seuls, à la fois à 310 nm (maximum de fluorescence du FBP) et 340 nm (maximum de fluorescence du Trp). Ces résultats sont conformes à une inhibition dynamique très rapide de la fluorescence. Nous avons également pu mettre en évidence une stéréo-sélectivité importante; l‘émission de la dyade (R,S) décline plus rapide que celle de la dyade (S,S). Il est important de noter qu'aucune montée de la fluorescence à 340 nm (TrpMe) n’a pu être observée, ce qui ne permet pas de valider l'idée d’un transfert d'énergie.
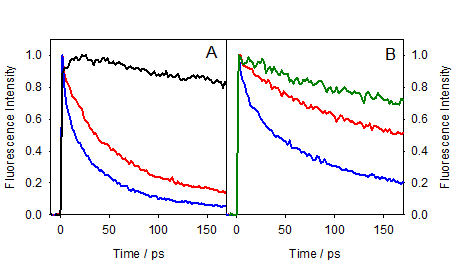
Les déclins de fluorescence des deux dyades à 450 nm, en revanche, sont caractérisés par une montée à l’échelle de la centaine de picosecondes, correspondant à la formation de l’exciplex. Comme un exciplex a un fort caractère de transfert de charge, ceci suggère que le mécanisme responsable pour l'inhibition de fluorescence peut être lié à un transfert d'électron.
Pour le complexe FBP/HSA, une inhibition importante de fluorescence est également observée (Figure 2A), quoique moins importante et avec une stéréo-sélectivité moins marquée que pour les dyades. Curieusement, la stéréo-sélectivité est inversée par rapport à celle observée pour les dyades, avec (S)-FBP montrant un déclin plus rapide que (R)-FBP.
Les déclins d'anisotropie de fluorescence à 310 nm (FBP) montrent également une stéréo-sélectivité marquée (Figure 2B), celle de (S)-FBP étant plus rapide que celle de (R)-FBP. La différence peut être liée à la dynamique orientationnelle du FBP dans la poche d’amarrage de la protéine, ce qui signifie que la relaxation conformationnelle est plus restreinte pour le (R)-énantiomère. Ce fait pourrait avoir des implications pour l'activité pharmaceutique du flurbiprofène.
À notre connaissance, ceci constitue la première observation d’une stéréo-sélectivité à l’échelle femto-/pico-seconde dans la dynamique d’interaction médicament-protéine.
[1] Excited state interactions between flurbiprofen and tryptophan in drug/protein complexes and in model dyads studied by time-resolved fluorescence spectroscopy. Thomas Gustavsson1, Dimitra Markovitsi1, Ignacio Vayá2, Paula Bonancía2, M. Consuelo Jiménez2, Miguel A. Miranda2,* Physical Chemistry Chemical Physics (2013).
1 CNRS, IRAMIS, SPAM, Francis Perrin Laboratoire, URA 2453, 91191 Gif-sur-Yvette, France.
2 Departamento de Química/Instituto de Tecnología Química UPV-CSIC, Universitat Politècnica de València, 46022 Valencia, Spain.
Contact CEA : Thomas Gustavsson



