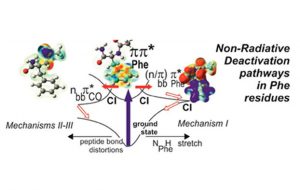
De nombreux systèmes moléculaires complexes absorbent la lumière dans l’UV, certains d’extrême importance pour la biologie, comme les bases de l’ADN ou les protéines. Les états excités peuplés par l’absorption UV bénéficient de mécanismes de désactivation d’importance majeure pour la photostabilité de ces espèces. Ces processus, souvent ultrarapides, offrent un moyen rapide et efficace de dissiper l’excitation électronique sous forme de vibra tion, évitant ainsi les réactions photochimiques. L’absorption des protéines dans le domaine des proches UV est principalement due à la présence de systèmes aromatiques provenant des acides aminés phénylalanine, tyrosine et tryptophane.
La photophysique de ces chromophores UV dépend généralement de leur environnement proche, et donc de la conformation locale de la protéine. Une connaissance des phénomènes photophysiques mis en jeu lors de la relaxation électronique peut être approfondie à travers l’étude en phase gazeuse de petits peptides modèles mimant des fragments de protéines. Une collaboration entre l’équipe SBM du Laboratoire Francis Perrin (CEA –CNRS URA2453), une équipe théorique de l’Institut Ruđer Bošković (Zagreb, Croatie – Projet HC-COGITO) et deux expérimentateurs du CLUPS (Paris Sud, Orsay) a permis de caractériser les états excités des conformères stables d’un peptide modèle et d’établir la nature des mécanismes de relaxation non radiative.1
Grâce aux récents développements des techniques expérimentales de la phase gazeuse, comme celles développées au sein de l’équipe SBM et au CLUPS, qui combinent désorption par laser, jet supersonique et méthodes optiques par laser comme la double résonnance IR/UV, on peut avoir accès à des données conformationnellement sélectives très précises ; en particulier la structure de chacun des conformères au travers de leur spectre infrarouge, leur énergie d’excitation adiabatique, la durée de vie de leur premier état excité et les effets de deutération sur cette dernière. Ces mesures offrent ainsi un moyen élégant de sonder l’influence de la conformation sur la photophysique d’un chromophore UV.
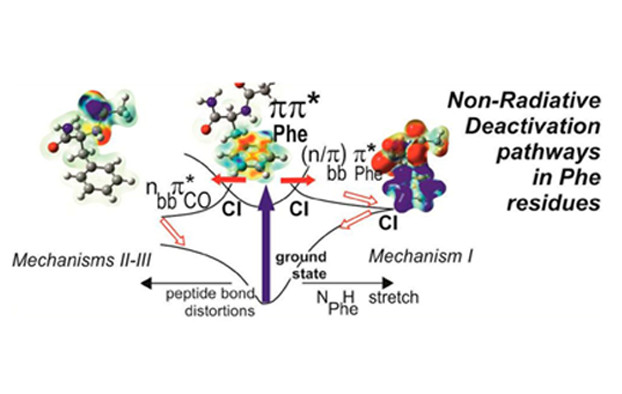
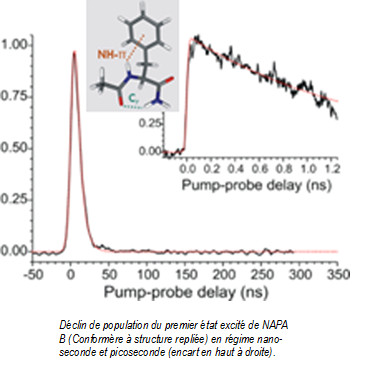
Dans cet objectif, les dynamiques de relaxation du premier état électronique excité d’un peptide protégé contenant un acide aminé phénylalanine (NAPA) et présentant trois conformères (A, B et C) à l’état fondamental2 ont été étudiées dans le domaine nanoseconde au CEA et picoseconde au CLUPS. Les durées de vies mesurées de cet état électronique excité varient de 1 à 70 ns et dépendent fortement de la conformation adoptée par la molécule. De plus, la substitution isotopique des atomes d’hydrogène des groupements NH et NH2 a permis d’apporter des informations supplémentaires sur leur rôle dans le processus de relaxation. La caractérisation complète des structures et la détermination des mécanismes de relaxation des premiers états excités nécessitent de faire appel à des modèles théoriques sophistiqués vu la taille des systèmes (> 30 atomes), leur flexibilité, la présence de liaisons non-covalentes qui gouvernent les structures et la nature très variée des premiers états excités (états localement excités et états à transfert de charge).
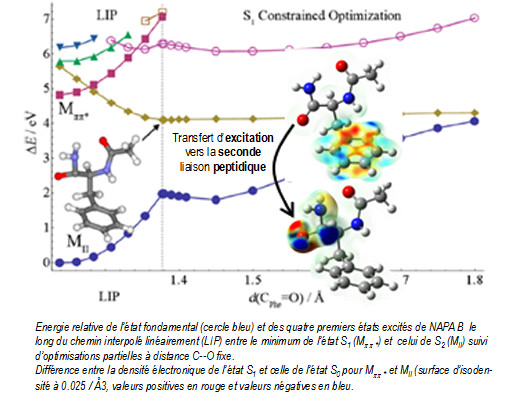
Une approche en double étape a été développée : (i) exploration la plus exhaustive possible des surfaces d’énergie potentielle des premiers états excités des différents conformères par une méthode de dynamique non-adiabatique utilisant la théorie de la fonctionnelle de la densité dépendante du temps (NA-TDDFT) afin d’identifier les coordonnées pertinentes des mécanismes et de localiser les intersections coniques puis (ii) calculs des profils énergétiques par une méthode Coupled Cluster à l’ordre 2 utilisant l’approximation RI ou résolution d’identité (RI-CC2) et différents protocoles d’optimisation.
La durée de vie mesurée (1.5 ns) du premier état excité pp* de la conformation repliée (NAPA B), 50 fois plus courte que celle de la conformation étendue (NAPA A), a pu ainsi être reliée à des mécanismes impliquant un transfert d’excitation électronique vers un état localement excité du type np* induit par une distorsion de la liaison peptidique. D’autres mécanismes de relaxation ont pu aussi être proposés pour expliquer les durées de vie très différentes des deux autres conformères de NAPA (A et C). Ces premiers résultats très encourageants ouvrent donc la voie à tout un nouveau champ d’études sur les mécanismes de désactivation d’importance majeure pour la photostabilité des protéines. Des études conjointes théorie-expérience sont en cours au sein de l’équipe SBM afin de comprendre l’influence de la microsolvatation ou du nombre de résidus sur ces mécanismes et l’extension au domaine femtoseconde des mesures sélectives en conformère vont être lancées conjointement avec le groupe DyR du SPAM dans le cadre du projet DIRCOS récemment accepté au LabEx PALM.
Références :
1Unravelling the Mechanisms of Radiationless Deactivation in Model Peptides Following Photoexcitation of a Phenylalanine Residue. Malis, M., Ljubjic, I., Doslic, N., Loquais; Y., Gloaguen, E., Tardivel, B., Broquier, M., Jouvet, C., Brenner, V., Mons, M., 2013, J. Am. Chem. Soc, 134, 20340.
2Probing the competition between secondary structures and local preferences in gas phase isolated peptide backbones. W. Chin ; F. Piuzzi, I. Dimicoli and M. Mons, 2006, Phys. Chem. Chem. Phys. 8, 1033.
Contacts :
Voir aussi pour l’état fondamental le fait marquant IRAMIS : Synergie expérience-théorie pour la simulation du repliement des protéines (Septembre 2010)