La description des interactions contrôlant la forme d’une protéine est cruciale dans la compréhension des mécanismes cellulaires, mais reste difficile à réaliser sur les systèmes biologiques en raison de leur complexité.
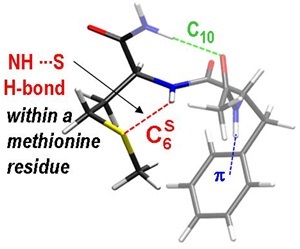
Dans ce contexte, l’utilisation de molécules modèles rend accessible à l’expérience de nombreuses problématiques biologiques se situant au cœur des grands enjeux sociétaux actuels. La spectroscopie IR/UV en phase gazeuse de petits peptides en est un remarquable exemple. L’étude de peptides contenant le résidu méthionine a récemment montré que les liaisons hydrogène NHamide—Sméthionine sont particulièrement fortes. Elles sont, par exemple, aussi fortes que les liaisons hydrogène “classiques” NHamide—OCamide qui définissent la structure secondaire des protéines.
L’analyse des structures de protéines répertoriées à ce jour révèle que le type de liaison NHamide—Sméthionine observé expérimentalement se produit sur 12% des méthionines. La comparaison des paramètres définissant la liaison NHamide—Sméthionine montre que les liaisons formées en phase gazeuse reproduisent fidèlement les liaisons observées dans les protéines. Ceci suggère fortement que les propriétés des liaisons NHamide—Sméthionine mises en évidence en phase gazeuse, leur force en particulier, sont identiques à celles se formant naturellement dans les protéines.
L’étude des contraintes imposées au squelette peptique par ces liaisons NHamide—Sméthionine montre qu’elles réduisent le domaine des valeurs autorisées pour les angles de Ramachandran. Ce phénomène commun aux peptides en phase gazeuse et aux protéines possédant ces liaisons NHamide—Sméthionine illustre ainsi l’effet que ces liaisons peuvent avoir sur la rigidité du squelette peptidique. Ces résultats permettent déjà d’ouvrir des pistes intéressantes dans la compréhension des mécanismes d’action d’antitumoraux.
Journal of Physical Chemistry Letters 2012, 3, 755−759
Michel MONS0 – 01 69 08 20 01
Eric GLOAGUEN – 01 69 08 35 82


