V. Brenner
Un des grands mystères du monde vivant est qu’il n’est pas symétrique. Les molécules chimiques ou biologiques, comme les acides aminés, peuvent a priori exister sous deux formes asymétriques. Comme nos deux mains, ces deux formes ne sont pas superposables mais sont le reflet l’une de l’autre dans un miroir. De telles molécules, pour lesquelles on distingue une espèce « droite » et « gauche », sont dites « chirales »[1]. Dans les organismes vivants, les protéines sont cependant exclusivement constituées d’acides aminés de type « gauche ». Cette sélection d’une seule des deux symétries est une des grandes énigmes scientifiques, à laquelle physiciens, chimistes et biologistes tentent de répondre.
Les protéines sont des chaînes extrêmement longues d’acides aminés. Chaque acide aminé s’ajoute par formation d’une liaison peptidique (CONH) et libération d’une molécule d’eau, laissant un résidu prolongeant la chaîne. Présentes dans les cellules, les protéines ainsi formées se replient et leur fonction dépend de leur conformation et pas uniquement de leur séquence. D’où l’importance de l’étude des mécanismes fondamentaux du repliement des protéines.
Deux équipes, l’une expérimentale et l’autre théorique, ont regroupé leurs forces pour s’attaquer à l’une des clés de ce mécanisme de repliement : les différents types de coudes β, structures secondaires responsables des changements de direction de la chaîne peptidique. Elles ont choisi d’étudier en phase gazeuse des peptides modèles simplement constitués de 2 acides aminés et complétés par des terminaisons spécifiques (Ac et NH2) pour miner le reste de la chaîne. L’intérêt de l’étude conjointe théorie-expérience est alors d’identifier sans ambiguïté les structures observées à partir de leur spectre infrarouge.
L’approche expérimentale originale développée dans l’équipe « Biomolécules excitées » consiste à porter en phase gazeuse les peptides à haute température dans un état dénaturé (i.e. désordonné) par désorption laser, puis à les laisser se refroidir dans une détente supersonique, par collisions avec le gaz porteur. Au cours du refroidissement, les peptides se replient et sont ensuite analysées a posteriori par spectroscopie optique laser.
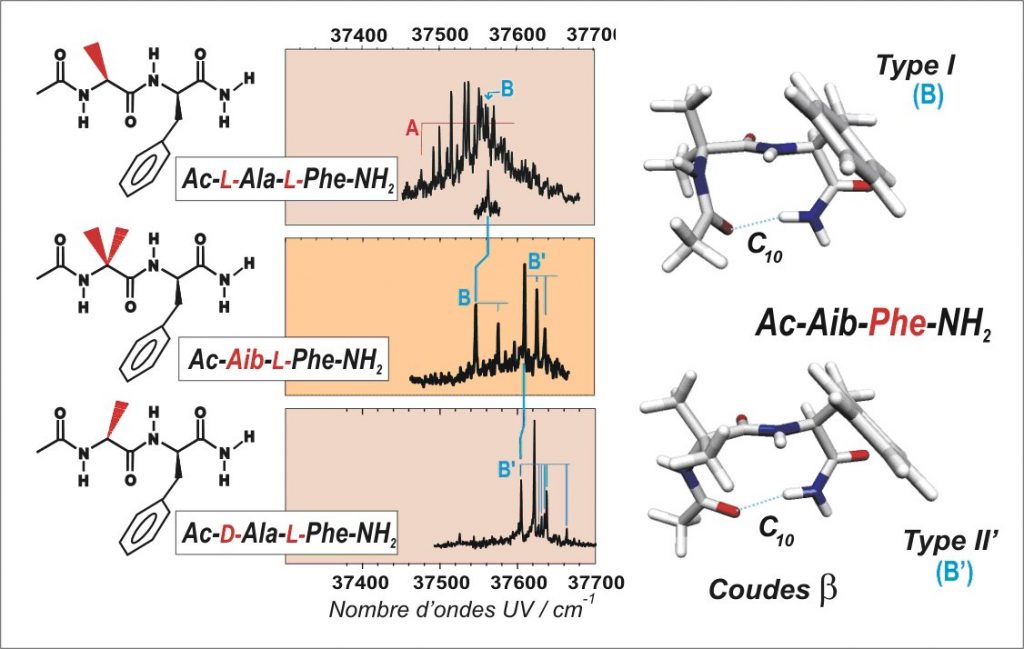
Ces approches ont permis de mettre en évidence le rôle de la chiralité des résidus (L ou D, pour lévogyre et dextrogyre) sur le repliement en coude β d’un petit peptide. On observe que le système Ac-Aib-L-Phe-NH2 comportant un résidu non chiral (Aib = acide amino-isobutyrique) autorise la formation de deux types de coudes β(B) et β(B’) (voir figure). On observe ensuite que le choix d’une chiralité définie L ou D, pour le premier résidu, conduit à la formation de coudes uniquement β(B) pour la combinaison homo-chirale (-L-Ala-L-Phe-) et β(B’) pour la combinaison hétéro-chirale (-D-Ala-L-Phe-).
Ainsi, dans la nature, l’homochiralité des chaînes impose un repliement de moindre variabilité tout en conférant une plus grande flexibilité à l’édifice moléculaire. Ce pourrait être une des raisons de la présence quasi exclusive d’acides aminés de même chiralité dans la nature. Ceci peut au contraire être mis à profit dans les applications pharmaceutiques, pour rigidifier une structure.
Références :
Chirality-controlled formation of β-turn secondary structures in short peptide chains: gas-phase experiment versus quantum chemistry, V. Brenner, F. Piuzzi, I. Dimicoli, B. Tardivel, and M. Mons, Angewandte Chemie International Edition, 46, (2007) 2463.
Voir aussi le fait marquant du DRECAM du 13/01/2006 : « Repliement de chaînes peptides en détente supersonique » et références associées.