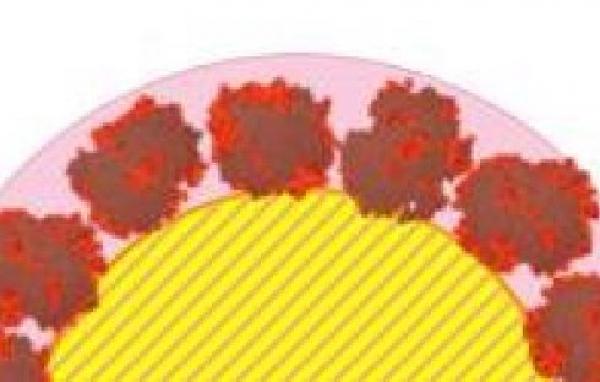
| Des chercheurs de l’I2BC@Saclay et de l’UMR NIMBE, en collaboration avec le Laboratoire Léon Brillouin (LLB), ont analysé la structure de la couronne composée de deux protéines modèles adsorbées sur des nanoparticules de silice, en utilisant la technique de diffusion des neutrons aux petits angles. Ils montrent que les structures formées sont de véritables nanoassemblages contrôlés, dans lesquels les protéines conservent leur forme. |
Les développements futurs en nanomédecine et en nanotoxicologie dépendent d'une meilleure compréhension du comportement des nano-objets dans les milieux biologiques (cellules, fluides intra- ou extracellulaires). Au contact de tels milieux, les nano-objets ne restent pas nus mais se recouvrent d'une ou plusieurs couches de protéines, appelée « corona ». Suivant la composition de cette couronne, une nanoparticule acquiert une "identité biologique" spécifique qui peut conditionner sa bio distribution ainsi que son éventuelle toxicité. Dans ce contexte, l'équipe interdisciplinaire de nanotoxicologie moléculaire, composée de chercheurs des instituts Joliot (SBIGeM et SB2SM) et du NIMBE s'intéresse depuis plusieurs années à l'adsorption des protéines sur les nanoparticules qu’elle étudie par des approches de physico-chimie, protéomique, biologie moléculaire, bio-informatique, modélisation et dynamique moléculaire.
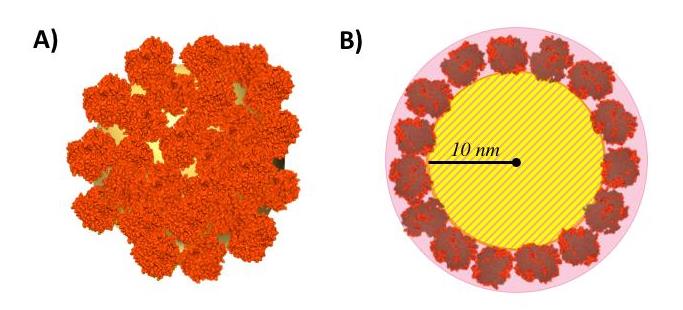
Au cours de travaux précédents, l'équipe a montré que pour des surfaces électronégatives telles que la silice, l'électrostatique gouverne le processus d'adsorption, favorisant la liaison de protéines riches en arginine (FM Joliot mai 2018). Les propriétés dynamiques sont également importantes, puisque les protéines fortement structurées, sont peu à même de se déformer au contact de la silice et donc de s'adsorber, contrairement aux protéines flexibles et/ou intrinsèquement désordonnées. Cependant, rien n’était connu sur la structure de la couronne une fois assemblée. Avec l’aide des compétences du Laboratoire Léon Brillouin, l’équipe a analysé la structure des couronnes de deux protéines modèles, la myoglobine et l'hémoglobine, adsorbées sur des nanoparticules de silice, en utilisant la technique de diffusion des neutrons aux petits angles. Dans le cas de l'hémoglobine, les chercheurs ont observé de larges modifications de sa capacité à fixer l'oxygène alors même que sa forme n’était pas modifiée. Cette analyse a également permis de mesurer l’épaisseur de la corona, montrant que les molécules d’hémoglobine forment une monocouche organisée à la surface de la nanoparticule.
L’objet ainsi formé est donc un véritable nanoassemblage contrôlé, permettant d’envisager le développement d’un nouveau type de biomatériaux à l’activité biologique maitrisée.
Référence :
Protein−nanoparticle interactions: what are the protein−corona thickness and organization?
L Marichal, G Giraudon-Colas, F Cousin, A Thill, J Labarre, Y Boulard, JC Aude, S Pin, JP Renault. Langmuir, 35 (2019) 10831.
Contact CEA-IRAMIS : Jean-Philippe Renault (NIMBE/LIONS)
Collaborations :
- Institut de Biologie Intégrative de la Cellule - I2BC@Saclay, CEA Saclay F-91191 Gif-sur-Yvette
- UMR 3685 CEA-CNRS NIMBE - Nanosciences et Innovation pour les Matériaux, la Biomédecine et l'Énergie, CEA Saclay F-91191 Gif-sur-Yvette
- Laboratoire Léon Brillouin (LLB), CEA Saclay F-91191 Gif-sur-Yvette.
• › Nanostructures et biomolécules : biomédecine et nanotoxicité / Nanostructures and biomolecules: biomedicine and nanotoxicity  Physique, chimie, nanosciences et matériaux autour des grands instruments › Matière Molle
Physique, chimie, nanosciences et matériaux autour des grands instruments › Matière Molle
• Laboratoire Léon Brillouin (LLB) • UMR 3685 NIMBE : Nanosciences et Innovation pour les Matériaux, la Biomédecine et l'Énergie
• Groupe "Matière molle et biophysique" - MMB • Laboratoire Interdisciplinaire sur l'Organisation Nanométrique et Supramoléculaire (LIONS)