


|
Le collagène est la protéine la plus abondante dans le corps humain, et sa structure particulière en triple hélice est à l’origine de propriétés mécaniques spécifiques au cartilage (élasticité, robustesse…), dont il est le composant majoritaire. Une collaboration entre physiciens, chimistes et radiobiologistes du laboratoire CIMAP étudie depuis quelques années l’irradiation du cartilage afin d’améliorer le traitement des tumeurs associées par hadronthérapie. Dans ce contexte, des expériences ont été menées sur des systèmes moléculaires isolés modèles de la triple hélice du collagène. Les résultats montrent que cette structure existe en l’absence de tout solvant, et que ses propriétés de stabilité sont les mêmes que dans les tissus biologiques. L’hypothèse longtemps admise d’une influence de l’eau est donc sans doute à exclure. |
Les propriétés mécaniques de certains tissus du corps humain (peau, ongles, cartilage…) proviennent en grande partie de leur composant majoritaire : le collagène. Cette protéine possède en effet une structure fibreuse qui lui donne une grande résistance à l’étirement, mais aussi une élasticité qui permet par exemple au cartilage d’amortir les chocs. Chaque fibre est formée de multiples brins, eux-mêmes composés de trois protéines enroulées l’une autour des deux autres en une structure en triple hélice spécifique du collagène (voir la figure 1). La solidité de cette triple hélice est renforcée par une modification post-traductionnelle abondante dans le collagène : l’hydroxylation (ajout du groupe –OH) de la proline, un des 22 acides aminés naturels qui composent les protéines. Cependant, les études antérieures menées en phase liquide ou solide ne permettent pas de savoir sans ambiguïté si cette solidité est une propriété intrinsèque du collagène ou due à une influence de l’eau environnant la triple hélice [1].
À travers le projet IRHEMME financé par la région Normandie, des physiciens, chimistes et biologistes du laboratoire CIMAP s’intéressent aux conséquences de l’irradiation du cartilage par des rayonnements ionisants, ce qui se produit notamment lors du traitement d’une tumeur cancéreuse par radio- et hadronthérapie. Cette approche pluridisciplinaire a pour but de sonder les effets de l’irradiation sur une gamme de temps très large, allant de la femtoseconde (ionisation) à l’heure (mort cellulaire).
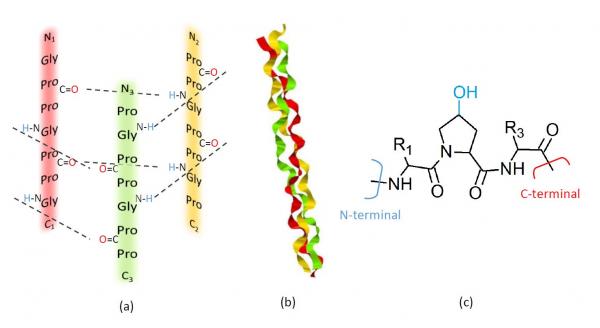
Structure moléculaire et assemblage en triple hélice du collagène :
(a) : Liaisons hydrogène (lignes pointillées) entre les trois chaînes polypeptidiques, composées du motif Pro-Pro-Gly, d’une triple hélice de collagène.
(b) : Structure tridimensionnelle d’une triple hélice modèle ((PPG)10)3 [2].
(c) : Ajout d’un groupement hydroxyle -OH sur le cycle pyrrolidine de la proline pour former le résidu 4-hydroxyproline (Hyp).
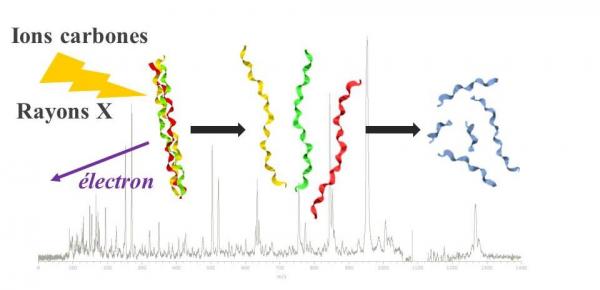
L'analyse par spectrométrie de masse des fragments formés au cours de l'irradiation par des photons ionisants permet de sonder la stabilité de modèles de la triple hélice du collagène.
Pour notre équipe, les processus physico-chimiques auxquels nous avons accès se déroulent jusqu’à une seconde après l’irradiation. De plus, ces processus ont été étudiés en l’absence de tout environnement, c’est-à-dire sur un système modèle isolé de la triple hélice du collagène. Grâce à des expériences de spectrométries de masse et de mobilité ionique couplées, menées à l’Institut Lumière Matière (Lyon), il est montré que cette structure est, sous certaines conditions, stable en l’absence de solvant et que cette stabilité est bien renforcée par l’hydroxylation des prolines. En collaboration avec une équipe de l'Université de Groningen, des expériences d'irradiation des structures modèles en triple hélice avec des photons ionisants au synchrotron BESSY2 à Berlin (Allemagne), couplées à une analyse par spectrométrie de masse (voir la figure 2), conduisent aux mêmes conclusions [3,4]. La stabilité de la triple hélice n’est donc sans doute pas intimement liée à son environnement dans les tissus.
Très récemment, l'irradiation au GANIL, de ces mêmes modèles isolés avec un faisceau d’ions carbones à l’énergie pertinente pour une hadronthérapie, ont permis d'observer de façon similaire les mêmes processus d’ionisation et de fragmentation de la triple hélice.
Références :
[1] Stabilization of the Collagen Triple Helix by O-Methylation of Hydroxyproline Residues,
F. W. Kotch, I. A. Guzei and R. T. Raines, J. Am. Chem. Soc.,, 130 (2008) 2952.
[2] Crystal and molecular structure of a collagen-like peptide at 1.9 A resolution
J. Bella, M. Eaton, B. Brodsky, and H.M. Berman. Science 266(5182) (1994) 75–81.
[3] Single-photon absorption of isolated collagen mimetic peptides and triple-helix models in the VUV-X energy range,
L. Schwob, M. Lalande, D. Egorov, J. Rangama, R. Hoekstra, R. K. Pandey, S. Eden, T. Schlathölter, V. Vizcaino and J.-C. Poully, Phys Chem Chem Phys, 19 (2017) 18321–18329.
[4] Radical-driven processes within a peptidic sequence of type I collagen upon single-photon ionisation in the gas phase,
L. Schwob, M. Lalande, D. Egorov, J. Rangama, R. Hoekstra, V. Vizcaino, T. Schlatholter and J.-C. Poully, Phys. Chem. Chem. Phys., 19 (2017) 22895–22904.
[5] "Ionisation et fragmentation de biomolécules sélectionnées en masse induites par impact d'ions et photo-absorption", thèse Lucas Schwob soutenue le 7 décembre 2016.
Voir aussi la revue récente :
Direct radiation effects on the structure and stability of collagen and other proteins
M. Lalande,[L. Schwob, V. Vizcaino, F. Chirot, P. Dugourd, T. Schlathçlter and J.-C. Poully, ChemBioChem 2019, 20, 2972.
Contact CEA-IRAMIS : Jean-Christophe Poully, Equipe AMA (Atomes, Molécules et Agrégats), Laboratoire CIMAP : Centre de recherche sur les Ions, les MAtériaux et la Photonique - UMR6252.
Collaboration :
- M. Lalande, L. Schwob, A. Méry, J. Rangama, V. Vizcaino, J.-C. Poully (équipe AMA), Y. Ngono-Ravache (équipe MADIR), F. Chevalier, Y. Saintigny (équipe LARIA) : Laboratoire CIMAP, UMR 6252 CEA, CNRS, ENSICAEN, UNICAEN Boulevard du Maréchal Juin, 14050 Caen Cedex, France
- D. Egorov, R. Hoekstra, T. Schlathölter : Zernike Institute for Advanced Materials, University of Groningen, Nijenborgh 4, 9747AG Groningen, Pays-Bas
- F. Chirot, P. Dugourd : Institut Lumière Matière, Université de Lyon, Université Lyon 1-CNRS, 69622 Villeurbanne cedex, France
•  Interaction laser-matière › Interaction lumière-matière
Interaction laser-matière › Interaction lumière-matière
• Centre de Recherche sur les Ions, les Matériaux et la Photonique











