|
En chimie, les "règles" du doublet, de l'octet et des 18 électrons permettent de concevoir des composés de grande stabilité chimique. Ces règles correspondent au principe de l'occupation complète des orbitales externes de chacun des atomes d'une molécule, soit respectivement s2, (s2, p6) et (s2, p6, d10). Chaque atome dispose ainsi, en partage avec ses voisins, d'une structure électronique externe en couches complètes, de type gaz rare : He, Ar, Ne, Xe et Kr. De la même façon, nous avons montré que des composés avec des liaisons impliquant 32 électrons, avec l'apport des quatorze électrons supplémentaires apportés par des orbitales 5f complètes, pouvaient être très stables. En montrant par des calculs de chimie quantique, la très grande stabilité d'une nouvelle famille de composés impliquant des liaisons à 32 e- entre un atome métallique central (actinide) et une cage ligand (Si20), la simple règle initiale tend à devenir un nouveau principe. Ce travail de recherche fondamentale est mené au Laboratoire de Chimie de Coordination des Éléments f à Saclay (IRAMIS/SIS2M/LCCEf) en collaboration avec le Prof. Pekka Pyykkö (Université d’Helsinki, Finlande) et le Dr. Carine Clavaguéra (CNRS, Ecole Polytechnique, Palaiseau). |
Dans les composés chimiques les plus stables, les atomes tendent à se combiner pour adopter une structure électronique en couche externe de type gaz rare : He s2, Ne et Ar (s2, p6), Kr et Xe (s2, p6, d10), ce qui conduit à énoncer les règles usuelles en chimie "du doublet" de l'octet et des 18-électrons. De la même façon, nous avons montré pour la première fois par des calculs de chimie quantique que des composés à 32-électrons pouvaient être stable, avec l'apport des 14 électrons des orbitales f complètes [1]. Si les orbitales 4f des lanthanides sont trop compactes (structure en couche externe du radon) pour permettre de construire ces composés, les couches 5f plus diffuses des actinides se sont révélées appropriées. Dans ces précédents travaux, le premier système à 32-électrons proposé est constitué d'un actinide occupant la cavité centrale d'une cage pour des séries isoélectroniques de Pu@M12 [1-2] (où M est le plomb ou l'étain) et de U@C28[3]. En montrant la validité de cette règle empirique pour de nouveaux composés, l’objectif est aujourd’hui d'ériger un nouveau principe.
Comme les règles du doublet, de l'octet (G. N. Lewis, 1916) et des 18-électrons (I. Langmuir, 1921), la règle des 32 électrons correspond à l'occupation maximale des couches externes du gaz rare au-delà du radon (Rn), ce qui, dans la classification périodique des éléments, conduirait à l'ununoctium (Uuo, Z=118), atome au noyau instable. Cependant, les calculs semblent montrer que cet élément n'est pas aussi inerte que les autres gaz rares moins massifs de la série (He, Ar, Ne, Kr, Rn). La règle des 32 électrons proposée ici n'est donc pas triviale.
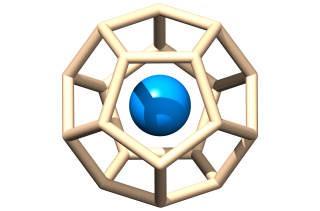
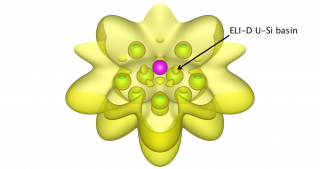
Suivant cette règle des 32 électrons, nous proposons une nouvelle famille de composés d'actinides basée sur une cage d’atomes de silicium Si20 [4]. L’approche théorique mise en œuvre repose sur des calculs de la théorie de la fonctionnelle de la densité (DFT) incluant les effets relativistes scalaire et de couplage spin-orbite. On montre ainsi que le composé [U@Si20]6- et la série isoélectronique [An@Si20]n- (où An est un actinide : An=Np, Pu, Am, Cm) sont énergiquement stabilisés dans des configurations spatiales de symétries Ih ou Th (Figure ci-dessus). La stabilité de ces systèmes est assurée par des liaisons chimiques entre l'atome central et les atomes de silicium de la cage. Elles sont mises en évidence par des analyses orbitalaires, énergétiques et topologiques qui montrent aussi le caractère covalent important de l’interaction An-Si. On observe par exemple sur la Figure ci-contre (analyse topologique ELI-D) une localisation spatiale des électrons entre les atomes U et Si (on parle de bassins de localisation des électrons) signature d’une interaction covalente U-Si.
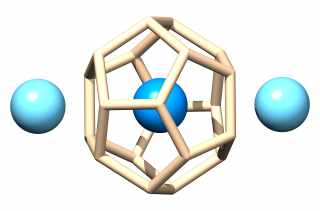
L'ajout de deux atomes de lanthanide donneurs d'électrons, sur les faces pentagonales de la cage Si20, permet de constituer un système neutre à 32-électrons tel que La2[U@Si20] (Figure 3), plus accessible expérimentalement. Chaque atome de lanthane transfère trois électrons à la cage de silicium. L'existence de cette famille très stable de composés, combinés avec des atomes donneurs appropriés, suggère qu'il devrait être possible de créer des agrégats à base de silicium contenant des actinides et de les assembler sous forme de structures plus complexes. Ces composés actinide-silicium pourraient conduire à des matériaux avec des propriétés électroniques, magnétiques et optiques nouvelles.
Ces travaux publiés dans Chemical Science [4] ont été sélectionnés comme fait marquant par Nature Chemistry :
"Filling in the blancks"
A. Pichon, Research Highlights, Nature Chemistry, 4 (2012) 690.
Références :
[1] J. P. Dognon, C. Clavaguéra, P. Pyykkö, Angewandte Chemie-International Edition 46 (2007) 1427.
[2] J. P. Dognon, C. Clavaguéra, P. Pyykkö, Comptes Rendus Chimie 13 (2010), 884.
[3] J. P. Dognon, C. Clavaguéra, P. Pyykkö, Journal of the American Chemical Society 131 (2009) 238.
[4] J. P. Dognon, C. Clavaguéra, P. Pyykkö, Chemical Science 3 (2012) 2843.
Contacts :
- Jean-Pierre Dognon, IRAMIS/SIS2M,
- Carine Clavaguéra, Laboratoire des Mécanismes Réactionnels, UMR 7651 - Ecole Polytechnique,
- P. Pyykkö, Department of Chemistry, University of Helsinki.
Voir aussi le fait marquant IRAMIS : Nouveau principe à 32 électrons : le cas de la famille de composés organométalliques An@C28 (An = Th, Pa, U, Pu).
et le communiqué CNRS : "32 électrons : d’une règle à un principe".
•  Physique et chimie pour le vivant et l’environnement › Chimie quantique et simulations moléculaires
Physique et chimie pour le vivant et l’environnement › Chimie quantique et simulations moléculaires
• UMR 3299 - Service Interdisciplinaire sur les Systèmes Moléculaires et les Matériaux
• Laboratoire de Chimie Moléculaire et Catalyse pour l'Energie (LCMCE)
• Théorie