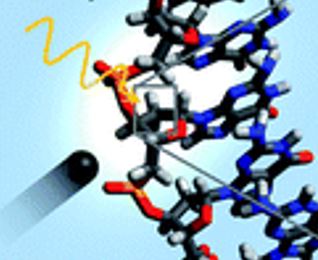
|
Lors d’une radiothérapie, il est généralement admis que les endommagements de l’ADN, tels que les cassures simple et double brins, sont à l’origine de la mort des cellules cancéreuses. Cependant seule la moitié des endommagements est due aux effets directs des rayonnements ionisants sur l'ADN, les effets indirects étant induits via l'environnement, l'eau notamment. Afin de mieux identifier et comprendre l'ensemble des mécanismes élémentaires des effets directs du rayonnement sur l'ADN, l'équipe Atomes, Molécules et Agrégats - AMA du CIMAP, en collaboration avec des équipes des Universités de Groningen et Potsdam, a étudié l’irradiation par rayons X (~ 300 eV, seuil K du carbone) et ions carbones (~ 12 MeV, C4+) de brins d’ADN isolés, et identifié les produits ioniques par spectrométrie de masse. Contrairement aux attentes, il est observé que le processus dominant de relaxation de l'excitation en couche interne est l’émission secondaire de plusieurs électrons de basse énergie cinétique par effet Auger, au lieu d’un unique électron de haute énergie. Ces électrons de basse énergie ont une faible profondeur de pénétration et peuvent à leur tour irradier l’ADN en causant de nouvelles cassures simple et double brins dans le proche environnement. Les endommagements secondaires sont ainsi plus nombreux et plus localisés qu'on ne le pensait. |
Lors du traitement d’un cancer par radiothérapie, des rayons X sont dirigés vers les cellules tumorales pour les tuer, du fait de la forte énergie transférée à la matière biologique. De son côté, l’hadronthérapie utilise des faisceaux d’ions (proton le plus souvent, mais aussi carbone) à la place des rayons X, ce qui permet de moins endommager les tissus sains, grâce à un dépôt d’énergie maximal dans la tumeur. Dans l’état actuel des connaissances, on pense que la mort des cellules tumorales est due à l’endommagement de leur ADN, sous forme de ruptures d’un ou des deux brins de la double hélice, les doubles brisures étant plus difficiles à réparer pour la cellule [1].
Ces rayonnements ionisants interagissent principalement avec les électrons de la matière, qui peuvent être éjectés des molécules présentes dans les cellules. Il a aussi été montré que des électrons de basse énergie peuvent induire des ruptures de l’ADN [2]. Il est ainsi important de bien identifier les mécanismes et quantifier l’énergie des électrons émis après l’interaction entre rayonnements ionisants et molécules. Le noyau est principalement composé d'ADN et d’eau. Les rayonnements ionisants peuvent donc interagir directement avec l’ADN et l’endommager (ce sont les effets directs), mais aussi avec l’eau, ce qui induit des effets indirects. Les effets directs sont responsables de la moitié des cassures de l’ADN [3].
Afin de mieux identifier les mécanismes directs d'endommagement de l'ADN sous l'effet du rayonnement, notre équipe AMA du CIMAP a choisi d’étudier, en collaboration avec les groupes de T. Schalthölter (Université de Groninguen, Pays-Bas) et M. Gühr (Université de Potsdam, Allemagne), des brins d’ADN déprotonés, chargés deux fois négativement en phase gazeuse, en l’absence d’eau. Comme l'ADN dans les systèmes biologiques est généralement chargé négativement, il est essentiel pour une étude biologiquement pertinente de se concentrer sur l'ADN dans cet état déprotoné.
Des brins d’ADN ont ainsi été irradiés avec des faisceaux de rayons X (synchrotron BESSYII, Berlin, Allemagne, photons au seuil K du carbone 280–310 eV) ou d’ions carbone (ligne IRRSUD, GANIL, Caen, France) à l’énergie cinétique pertinente pour l'hadronthérapie (C4+ de ~ 12 MeV), puis analysé les produits ioniques de l’irradiation par spectrométrie de masse.
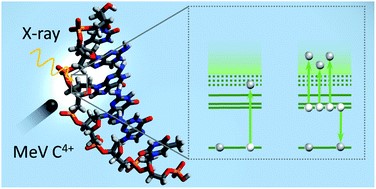
Les résultats montrent qu’un électron de haute énergie peut être émis de la molécule après absorption d’un photon X ou collision avec un ion carbone, ce qui avait déjà été montré dans des études précédentes, mais que le processus majoritaire est l’émission de plusieurs électrons de basse énergie [4]. Ce dernier processus est accompagné d’une cassure du brin d’ADN en petits fragments chargés positivement. De plus, des expériences complémentaires d’irradiation par laser à impulsion femtoseconde montrent que ces fragments sont bien causés par l’éjection de plusieurs électrons de valence de la molécule.
Ces électrons de basse énergie cinétique ont une plus faible profondeur de pénétration dans la matière et sont plus nombreux que l’unique électron de haute énergie. Les cassures de l’ADN induites par ces électrons seront ainsi plus abondantes et plus proches de la molécule initialement irradiée. Les effets directs de l’irradiation de l’ADN sont ainsi plus nombreux et plus localisés qu'on ne le pensait.
Références :
[1] Carbon-ion radiotherapy: principles, practices, and treatment planning,
H. Tsujii, T. Kamada, T. Shirai, K. Noda, H. Tsuji, K. Karasawa, Springer Japan (2014).
[2] Electron-induced damage of DNA and its components: experiments and theoretical models,
I. Baccarelli, I. Bald, F.A. Gianturco, E. Illenberger, J. Kopyra, Physics Reports - Review Section of Physics Letters 508 (2011) 1–44.
[3] Chemical mechanisms of single- and double-strand break formation in irradiated SV40 DNA
R.E. Krisch, M.B. Flick, C.N. Trumbore, Radiation Research 126(2) (1991) 251–259.
[4] Multiple valence electron detachment following Auger decay of inner-shell vacancies in gas-phase DNA,
W. Li, O. Kavatsyuk, W. Douma, X. Wang, R. Hoekstra, D. Mayer, M. S. Robinson, M. Gühr, M. Lalande, M. Abdelmouleh, M. Ryszka, J.-C. Poully and T. Schlathölter, Chem. Sci. 12 (2021) 13177.
Contact IRAMIS : Jean-Christophe Poully (CIMAP/AMA).
Collaboration :
- M. Lalande, M. Abdelmouleh, M. Ryszka et J.-C. Poully, Laboratoire CIMAP, UMR 6252 CNRS, GANIL Bd Becquerel, 14070 Caen Cedex 05, France.
- W. Li, O. Kavatsyuk, W. Douma, X. Wang, R. Hoekstra et T. Schalthölter, University of Groningen, Zernike Institute for Advanced Materials, Nijenborgh 4, 9747AG Groningen, Netherlands.
- D. Mayer, M. S. Robinson et M. Gühr, Universität Potsdam, Institut für Physik und Astronomie, 14476 Potsdam, Germany.
•  Interaction laser-matière › Interaction lumière-matière
Interaction laser-matière › Interaction lumière-matière  Physique et chimie pour le vivant et l’environnement
Physique et chimie pour le vivant et l’environnement
• Centre de Recherche sur les Ions, les Matériaux et la Photonique