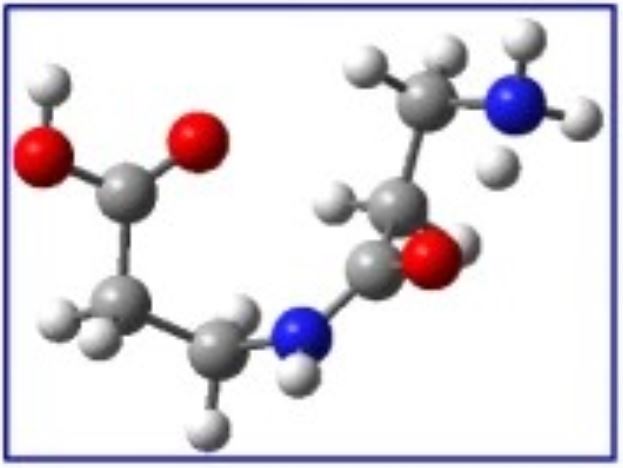
|
La recherche de l'origine de la vie demande d'identifier chaque étape élémentaire d'une longue chaine de processus pouvant, à partir des atomes issus de la nucléosynthèse au cœur des étoiles (essentiellement de l'hydrogène au fer) ou sous l'effet de l'explosion finale des supernovæ (éléments lourds au-delà du fer), conduire à la formation des générations successives de molécules de plus en plus complexes, pour aboutir aux molécules constitutives du vivant telles qu'elles sont présentes sur Terre. Il existe de nombreuses preuves montrant que les premières étapes, jusqu'à la formation d'acides aminés, peuvent se produire dans l'espace. Au-delà, l'évolution vers des molécules de complexité croissante passe par la création de liaisons peptidiques permettant l'assemblage d'acides aminés. L'équipe du CIMAP, en association avec des équipes de l'Université Autonome de Madrid, montre par des travaux couplant expérience et théorie que les collisions de particules alpha (ou noyau d'hélium) ayant des énergies typiques des vents stellaires peuvent former dans l'espace des liaisons peptidiques au sein d'agrégats d'acides aminés. The search for the origin of life requires the identification of each elementary step in a long chain of processes that can, from the atoms resulting from nucleosynthesis within stars (mainly from hydrogen to iron) or in the final explosion of supernovae (heavy elements beyond iron), lead to the formation of successive generations of increasingly complex molecules, to arrive at the constituent molecules of life as they are present on Earth. There is ample evidence that the first steps, up to the formation of amino acids, may occur in space. Beyond that, the evolution towards molecules of increasing complexity involves the creation of peptide bonds allowing the assembly of amino acids. The CIMAP team, in association with teams from the Autonomous University of Madrid, shows, through work combining experience and theory, that collisions of alpha particles (i.e. helium nuclei) with amino acid aggregates at energies typical of stellar winds can form peptide bonds in space. 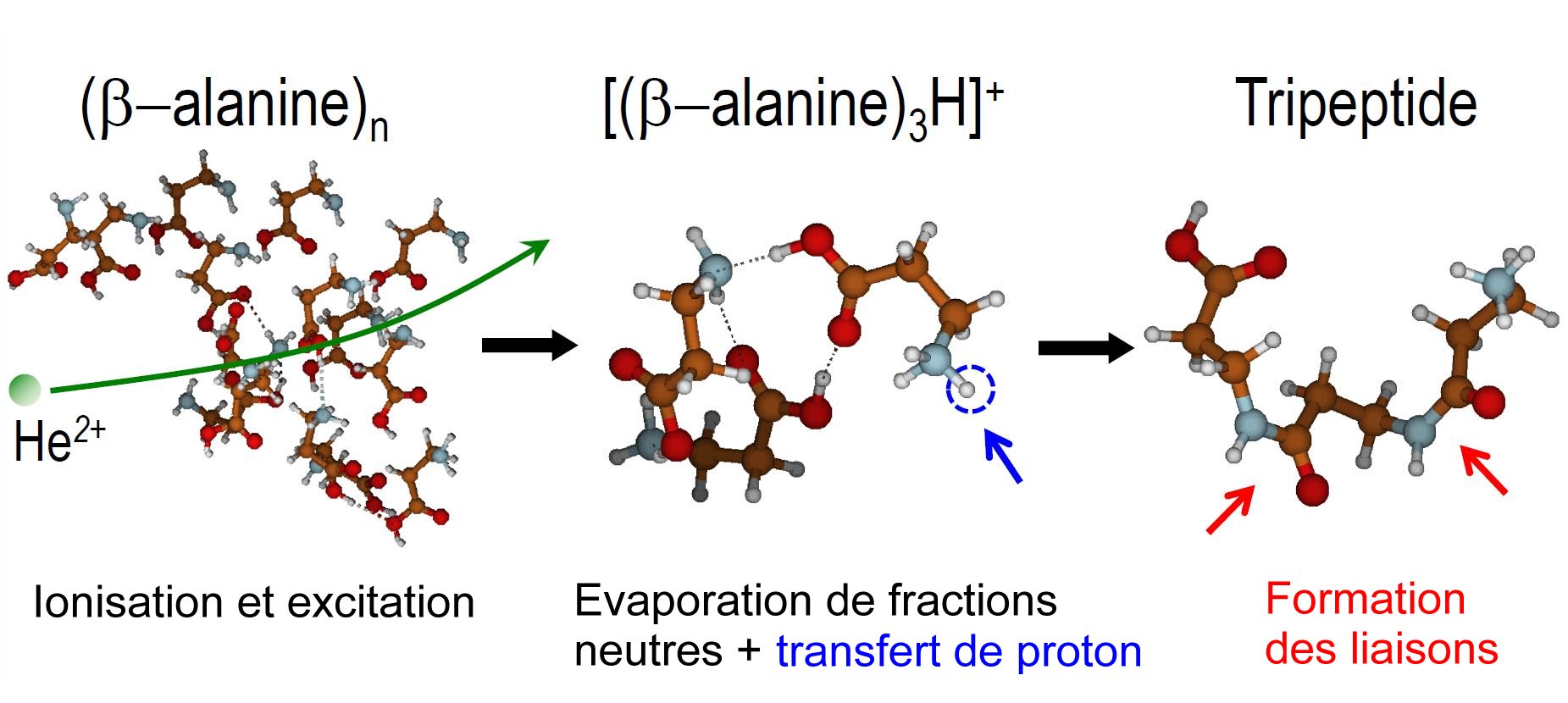 |
Du fait de la très faible densité du milieu interstellaire, des nuages protostellaires ou de l'environnement des étoiles, si les réactions de synthèse de molécules complexes peuvent être rares dans l'espace et peu efficaces, elles se produisent sur des millions d'années. On observe ainsi par exemple que l'irradiation de glaces contenant du carbone (H2O, CO, NH3, CH3OH…) conduit, même si les sections efficaces sont faibles, à la formation d'acides aminés, tels que l'on peut les retrouver sur certaines météorites*. Les acides aminés étant ainsi présents dans l'espace, la réalisation de liaisons peptidiques (liaison entre le groupe amine -NH2 d'un acide aminé et le groupe acide carboxylique -COOH d'un autre acide aminé) est l'étape suivante indispensable à la formation de molécules biologiquement actives. Cette réaction pouvant se produire sur Terre ou dans l'espace.
L'équipe AMA du CIMAP, en association avec des équipes de l'Université Autonome de Madrid, a ainsi étudié expérimentalement au laboratoire, la possibilité de formation de liaisons peptidiques par collisions simples d'ions He2+ de faible énergie (ou particules α), à des énergies d'impact typiques du vent solaire, avec des groupes de molécules d'alanine β (β-ala, NH2CH2CH2COOH) faiblement liées. Les produits cationiques sont analysés par spectrométrie de masse à temps de vol, et l'on observe divers produits fractionnaires entre les polypeptides (β-ala)n, et parmi ceux-ci des peptides clairement identifiables.
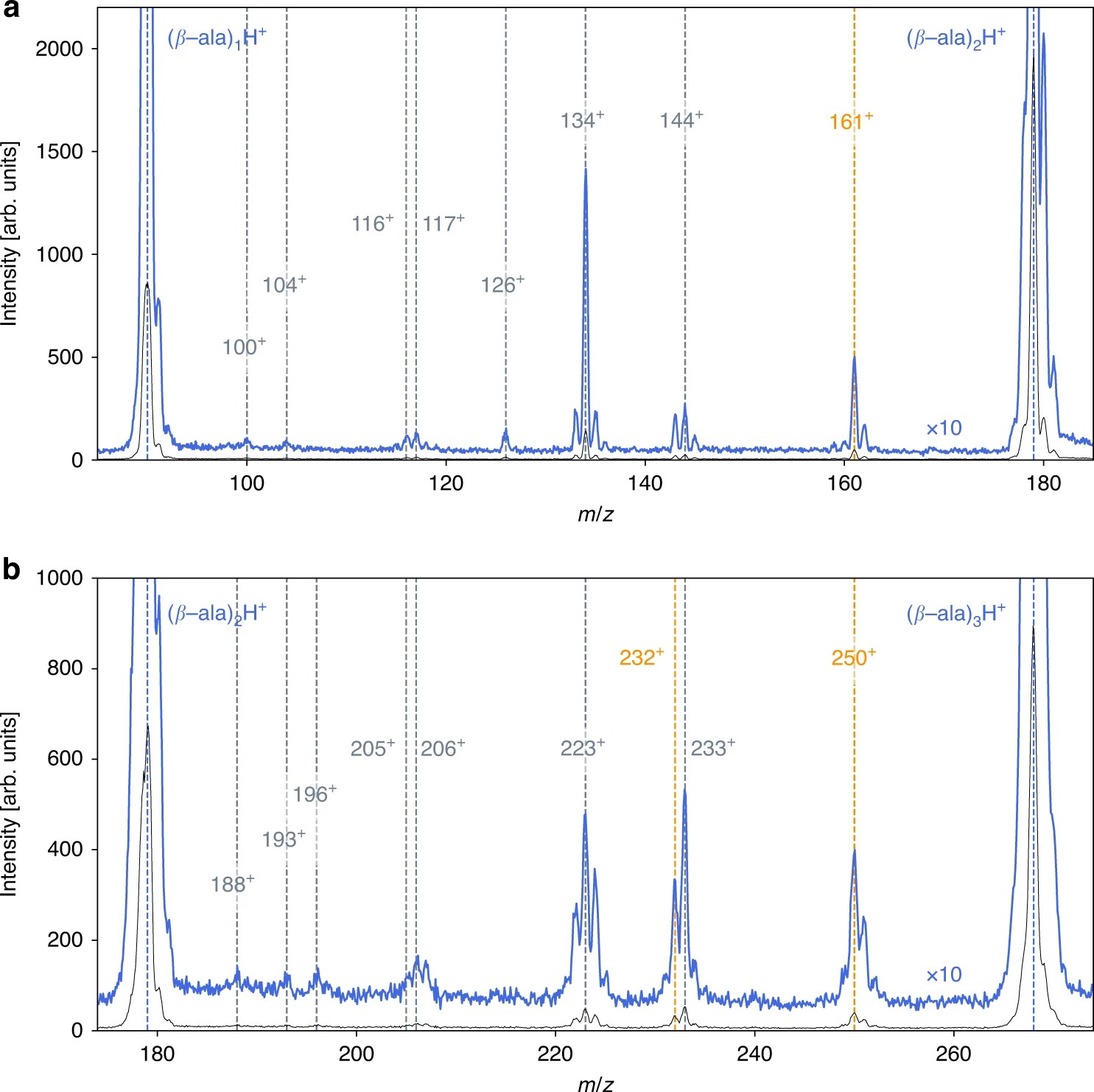
Spectres de masse montrant les produits de réaction ionisés une fois, résultant des collisions entre des projectiles He2+ de 30 keV et des agrégats froids d'alanine β (masse 89). Courbes bleues : intensité x 10. En haut : masses entre monomère et dimère (89-178) ; en bas : masses entre dimère et trimère (178 – 267). Les clusters dominants sont protonés [(β−ala)nH]+, m/z = 90, 179, et 268. Les peptides produits par collision avec les ions He2+ sont mentionnés en orange.
Il est ainsi montré que les liaisons peptidiques sont efficacement formées par l'émission de molécules d'eau, conduisant à la formation de molécules complexes pouvant aller jusqu'à la formation de tétrapeptides (assemblage de 4 acides aminés). Les spectres de masse des produits de fragmentation sont ensuite comparés à des résultats de simulations de dynamique moléculaire, où une exploration exhaustive des surfaces potentielles énergétiques a été menée.
Cette formation de polypeptides par collision avec les ions He2+ est obtenue par ionisation des molécules par transfert de charge depuis l’ion et excitation électronique par transfert d’énergie cinétique du projectile au système de molécules. Ce processus est suivi par un transfert de protons qui conduit à des amas moléculaires transitoires, faiblement liés et protonés. Ces entités sont ensuite stabilisées par la formation des liaisons peptidiques, ce qui libère des molécules d'eau via des chemins réactionnels où les barrières énergétiques sont faibles. Une des spécificités essentielles de cette chaine réactionnelle est la faible excitation du système, résultant de la capture électronique lointaine et du caractère léger de l’ion.
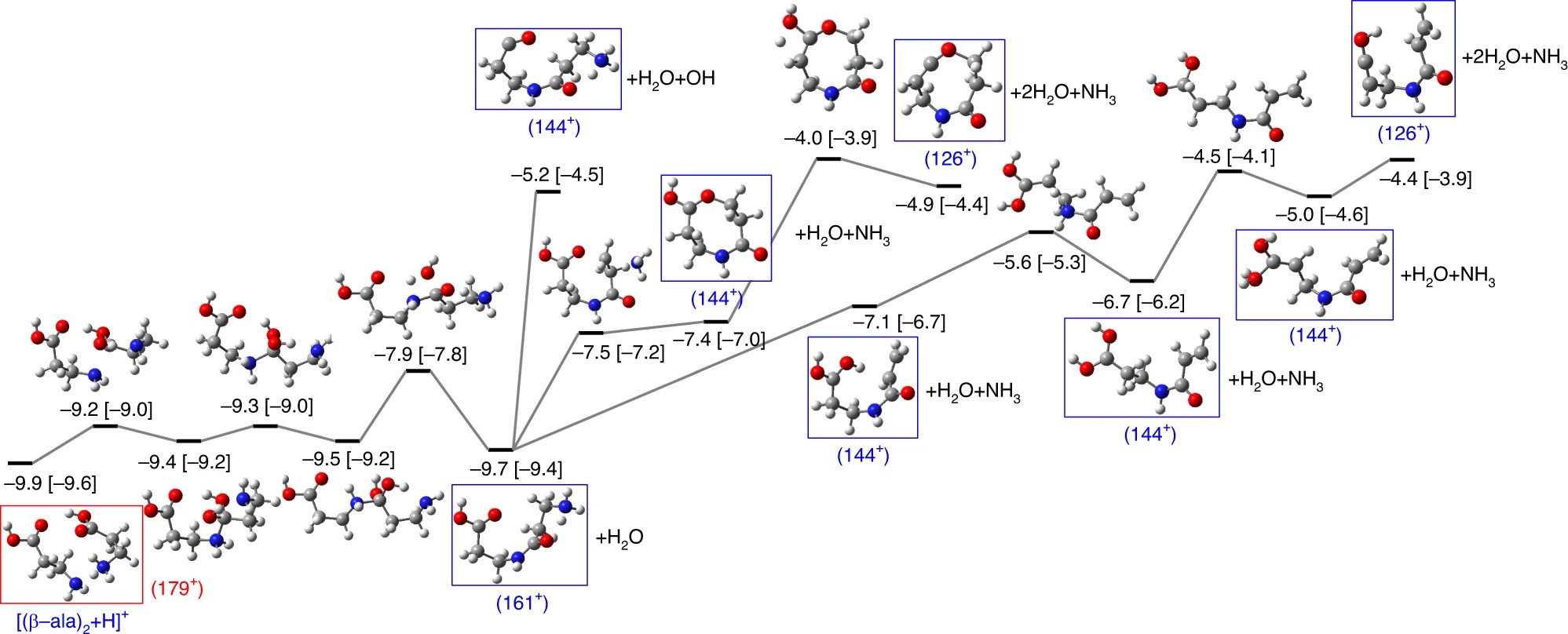
Exploration systématique des surfaces potentielles énergétiques à partir (en bas à gauche) d'un dimère d'acide aminé protoné. Le schéma montre ainsi la voie réactionnelle vers la formation du dipeptide m/z = 161, noté 161+, observé expérimentalement, et la formation de divers fragments.
Ainsi, ces résultats montrent que la collision d'ions énergétiques avec des petits groupes d'acides aminés est une voie plausible de formation de polypeptides dans l'espace. Ces collisions pouvant être retenues parmi les processus à l'origine de la formation des molécules complexes du vivant.
Ces recherches couplant expérience et théorie ont été menées dans le cadre du laboratoire collaboratif international (LIA) DYNAMO (Fragmentation DYNAmics of complex MOlecular systems).
Références :
P. Rousseau, D. G. Piekarski, M. Capron, A. Domaracka, L. Adoui, F. Martín, M. Alcamí, S. Díaz-Tendero and B. A. Huber, Nature Communication (2020).

*Voir les faits marquants antérieurs :
- "La possible contribution des ions lourds à la formation de molécules complexes carbonées dans l'espace interstellaire : expériences et modélisations"
- "Astrochimie : formation de molécules sur Europa par implantation d'ions"
Contact CEA-IRAMIS : Patrick Rousseau (CIMAP/AMA)
Collaboration :
- Patrick Rousseau, Michael Capron, Alicja Domaracka, Lamri Adoui & Bernd A. Huber : Normandie Univ, ENSICAEN, UNICAEN, CEA, CNRS, CIMAP, 14000, Caen, France
- Dariusz G. Piekarski, Fernando Martín, Manuel Alcamí & Sergio Díaz-Tendero : Departamento de Química, Módulo 13, Universidad Autónoma de Madrid, 28049, Madrid, Spain
- Fernando Martín & Sergio Díaz-Tendero : Condensed Matter Physics Center (IFIMAC), Universidad Autónoma de Madrid, 28049, Madrid, Spain
- Fernando Martín & Manuel Alcamí : Instituto Madrileño de Estudios Avanzados en Nanociencias (IMDEA-Nanociencia), Cantoblanco, 28049, Madrid, Spain
- Manuel Alcamí & Sergio Díaz-Tendero : Institute for Advanced Research in Chemical Sciences (IAdChem), Universidad Autónoma de Madrid, 28049, Madrid, Spain.
•  Interaction laser-matière › Interaction lumière-matière
Interaction laser-matière › Interaction lumière-matière
• Centre de Recherche sur les Ions, les Matériaux et la Photonique