| Une collaboration entre une équipe de l'IRAMIS/NIMBE et deux équipes de l'I2BC@Saclay mettent en évidence l'affinité très forte de nanoparticules de silice pour des protéines de liaison de l'ARN présentant des séquences de base nucléique à motifs RGG (R = Adenine ou Guanine - Guanine-Guanine). Cette affinité est plus particulièrement renforcée lorsque celles-ci sont méthylées. Ces résultats sont importants pour le développement d'approches "safe by design", visant à minimiser l’écotoxicité des nanomatériaux, dès la conception d’un produit. |
L'adsorption des protéines sur les surfaces inorganiques est une question fondamentale avec de multiples implications dans le domaine des prothèses, bio senseurs, nanoparticules, etc.... L'utilisation croissante de nanoparticules manufacturées, notamment dans l'industrie alimentaire avec le dioxyde de titane (E171) ou la silice (E551) pose la question de leur devenir biologique une fois ingérées. La taille nanométrique (< 100 nm) des nanoparticules leur confère une surface spécifique très élevée et la capacité à rentrer dans les cellules.
Au contact d'un milieu biologique (cellule, fluides intra- ou extracellulaires), les nanoparticules ne restent pas nues, mais se recouvrent d'une ou plusieurs couches de protéines. C'est cette nouvelle entité qui est prise en charge par l'organisme et qui conditionne sa bio-distribution et sa toxicité potentielle. Dans ce contexte, l'équipe interdisciplinaire de nano-toxicologie moléculaire composée de chercheurs des instituts Joliot et Iramis s'intéresse depuis plusieurs années à l'adsorption des protéines sur les nanoparticules par des méthodes de physico-chimie, protéomique, biologie moléculaire, bioinformatique, modélisation et dynamique moléculaire.
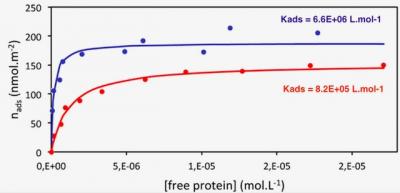
Figure 1 : Mesure des constantes d'adsorption (Kads) des protéines sur la silice par la méthode des isothermes, pour deux peptides synthétiques 25-mer contenant 6 séquences de base nucléique à motifs RGG (R = Adenine ou Guanine - Guanine-Guanine). Les résidus arginine (acide α-aminé) du peptide P1 (courbe rouge) ne sont pas modifiés, alors que les résidus arginine du peptide P2 (courbe bleue) sont di-méthylés asymétriquement.
Au cours de travaux précédents, l'équipe a montré que pour des surfaces électronégatives telles que la silice, l'électrostatique gouverne le processus d'adsorption, favorisant la liaison de protéines riches en arginine. Les propriétés dynamiques sont également importantes, puisque les protéines fortement structurées, sont peu à même de se déformer au contact de la silice et donc de s'adsorber, contrairement aux protéines flexibles et/ou intrinsèquement désordonnées. Parmi ces protéines flexibles et/ou désordonnées ayant une forte propension à s'adsorber, il s'avère aussi que c'est le groupe des protéines liant l'ARN qui est le plus représenté, et particulièrement une sous-classe d'entre elles, les protéines à motifs RGG (Arg-Gly-Gly). L'équipe s'est donc intéressée à ces protéines et montre dans cette étude que leur forte affinité pour la silice est due à ces motifs, plus précisément aux résidus Arg de ces motifs lorsque ceux-ci sont diméthylés asymétriquement. Ces résultats ont été obtenus par des approches complémentaires ex vivo, in vitro (à l'aide de peptides de synthèse – voir Figure 1) et in silico (simulations en dynamique moléculaire).
Ces travaux, qui contribuent à une meilleure connaissance des mécanismes d'adsorption des protéines, pourraient à terme permettre de mieux concevoir les surfaces et les nanoparticules en fonction des applications souhaitées, en particulier dans le domaine médical et éventuellement de prédire quelles protéines et quelles fonctions cellulaires risquent d'être affectées par la présence de nanoparticules. Une piste à explorer pour minimiser l’écotoxicité des nanomatériaux dès la conception d’un produit (élaboration "safe by design" ) !
Référence :
Importance of post-translational modifications in the interaction of proteins with mineral surfaces: the case of arginine methylation and silica surfaces
L Marichal, JP Renault, S Chédin, G Lagniel, G Klein, JC Aude, C Tellier, J Armengaud, S Pin, J Labarre, Y Boulard, Langmuir 34 (18) (2018) 5312-5322.
Contact CEA-IRAMIS : Jean-Philippe Renault (NIMBE/LIONS)
• › Nanostructures et biomolécules : biomédecine et nanotoxicité / Nanostructures and biomolecules: biomedicine and nanotoxicity
• UMR 3685 NIMBE : Nanosciences et Innovation pour les Matériaux, la Biomédecine et l'Énergie
• Laboratoire Interdisciplinaire sur l'Organisation Nanométrique et Supramoléculaire (LIONS)