|
L'émergence des véhicules électriques et du stockage des énergies renouvelables souligne le besoin d’augmenter la densité énergétique des batteries tout en diminuant leurs coûts et en améliorant leur sécurité. Les batteries magnésium-ion apparaissent comme une excellente alternative aux batteries Li-ion grâce à la forte capacité spécifique du Mg, son faible coût et son abondance sur Terre. Dans ce travail, une équipe de l’IRAMIS a développé un nouveau matériau d’électrode négative pour les batteries Mg-ion : InSb. Il est démontré qu’une réelle synergie chimique existe entre les deux éléments In et Sb : la combinaison de ces deux métaux permet de montrer pour la première fois la contribution partiellement réversible de Sb dans les alliages pour batteries Mg-ion. Ce travail est publié dans la revue The Journal of Physical Chemistry C. |
Le développement des énergies renouvelables intermittentes et des technologies mobiles est étroitement liée à la capacité de stocker massivement de l’électricité avec des technologies fiables et performantes. Le développement des batteries lithium-ion a principalement contribué à cet essor. Toutefois, cette technologie semble atteindre ses limites et de nouvelles solutions émergent comme les batteries magnésium. Le magnésium présente de nombreux avantages dont les principaux sont :
- l’échange de 2 électrons, au lieu d’un pour le lithium,
- une capacité volumétrique particulièrement élevée de 3833 mAh ml-1, comparée à 2062 mAh ml-1 pour le lithium [2].
Le fonctionnement d’une batterie Mg est similaire à celui d’une batterie Li-ion, impliquant l’échange d’ions Mg2+ entre une électrode positive et une électrode négative idéalement du magnésium métal, via une solution d’électrolyte.
Cependant, les électrolytes conventionnels interagissent fortement avec le Mg métallique pour former une couche de passivation bloquante en surface, inhibant les réactions électrochimiques réversibles dans la cellule. De leur côté, les électrolytes organométalliques sont compatibles avec le Mg métal, mais leur fenêtre de potentiel reste très étroite. Une des solutions pour résoudre ces deux problèmes est le remplacement du Mg pur de l'électrode par des composés formant un alliage avec le Mg et pouvant être stables face aux électrolytes. Les éléments favorables pouvant être utilisés dans ce but sont typiquement ceux du bloc p du tableau périodique, dont les capacités massiques bien que plus faibles, restent encore suffisantes pour assurer une augmentation substantielle de la capacité des batteries.
Ainsi, afin d’améliorer les performances des électrodes négatives pour batteries Mg-ion, l’équipe du LEEL a pensé à utiliser l’alliage InSb, afin d’observer un possible effet de synergie entre les éléments In et Sb sur les performances électrochimiques. L’alliage InSb, synthétisé par mécanosynthèse, peut bénéficier du bas potentiel d’alliage de l'indium (0.09 VMg) et de la bonne capacité théorique de l'antimoine (Sb : 660 mAh g-1), même s'il a été rapporté dans la littérature que cet élément devrait rester électrochimiquement inactif.

|
|
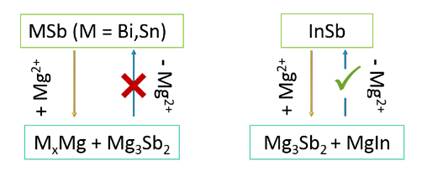
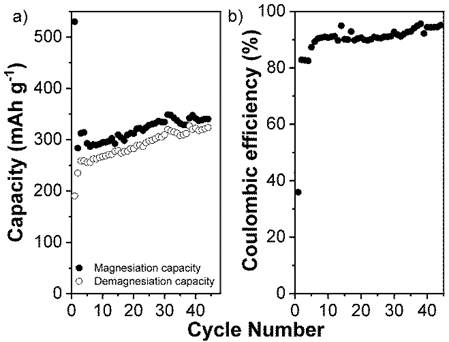
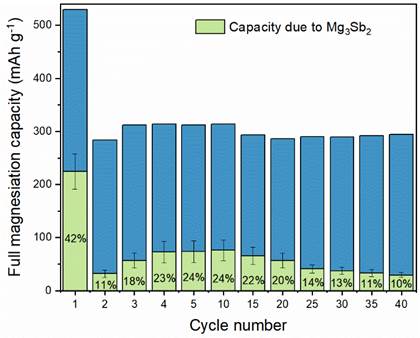
L'apport d'une électrode en alliage InSb a été étudié par analyse électrochimique et diffraction des rayons X (XRD) ex situ. L’évolution du potentiel en fonction du temps (Figure ci-dessus) de la première magnésiation met en évidence deux réactions successives correspondant à la formation de Mg3Sb2 et MgIn. Étonnamment, les analyses DRX suggèrent une amorphisation électrochimique de MgIn dépendante de la cinétique de réaction. De plus, pour la première fois, il est démontré que contrairement au cas du Sb pur ou des alliages BiSb et SnSb, l’activation de Sb est possible dans l’alliage InSb (Figure ci-dessus, à droite) et la formation de l’alliage Mg3Sb2 lors de la décharge est partiellement réversible. Au cours du tout premier cycle de charge, une capacité de InSb de 535 mAh g-1 est mesurée, bien supérieure à celle de l’indium seul (Figure (a) ci-dessous). La formation de Mg3Sb2 est responsable de 42% de la capacité de la première décharge. Cependant dès le cycle suivant, cette capacité se trouve brutalement réduite pour atteindre une valeur de l’ordre de 300 mAh g-1, avec une contribution de Mg3Sb2 entre 10 et 20% (Figure ci-dessous, à droite).
|
|
Au cours des 40 cycles de charge-décharge suivants les performances électrochimiques restent pratiquement constantes, avec une bonne stabilité de l'électrode, sans formation a priori de couche passivante, ce qui était le principal but recherché. Des travaux sont en cours pour déterminer et comprendre les mécanismes responsables de l’activation de Sb dans l'alliage InSb retenu, qui apparait donc comme prometteur pour le développement de batteries magnésium.
Références :
[1] Unexpected behavior of the InSb alloy in Mg-Ion batteries: unlocking the reversibility of Sb.
Lucie Blondeau, Eddy Foy, Hicham Khodja, Magali Gauthier, The Journal of Physical Chemistry C, 123 (2019) 1120.
[2] Quest for nonaqueous multivalent secondary batteries: magnesium and beyond
Muldoon, J., Bucur, C. B., Gregory, T., Chem. Rev. 114, (2014) 11683–11720
Contact CEA IRAMIS : Magali Gauthier (NIMBE/LEEL).
•  Matériaux des nouvelles technologies pour l’énergie › Chimie des (nano-)matériaux pour l’énergie / Chemistry of (nano-)materials for energy
Matériaux des nouvelles technologies pour l’énergie › Chimie des (nano-)matériaux pour l’énergie / Chemistry of (nano-)materials for energy
• UMR 3685 NIMBE : Nanosciences et Innovation pour les Matériaux, la Biomédecine et l'Énergie
• Laboratoire archéomatériaux et prévision de l'altération (LAPA) • Laboratoire d'Etude des Eléments Légers (LEEL)