|
La résonance magnétique nucléaire permet l’étude de la structure et de la dynamique moléculaire par l’acquisition des spectres à haute résolution et la mesure des temps de relaxation. Les temps de relaxation mesurables sont typiquement de l'ordre de la période de précession du moment magnétique, lors de son retour à l'équilibre, et donc fonction de la valeur du champ magnétique polarisant. Une collaboration de chercheurs de l'ENS-Paris et de l'IRAMIS a développé une méthode originale permettant, par une variation du champ magnétique polarisant, de mesurer les relaxations lentes et rapides d'un même système moléculaire, tout en préservant une haute résolution spectrale. |
La résonance magnétique nucléaire (RMN) est une méthode très puissante d'étude d'un système moléculaire. La combinaison des mesures structurales par l’acquisition de spectres RMN à haute résolution et de dynamique moléculaire, par la mesure des temps de relaxation associés, permet l’analyse des mouvements moléculaires sur plusieurs échelles de temps allant de 10-12 sec pour les rotations/vibrations, à quelques secondes pour des phénomènes d’échange chimique.
Dans une mesure RMN, le moment magnétique initialement aligné sur le champ magnétique statique polarisant de l’aimant de RMN, est désorienté par l'application d'une impulsion radiofréquence. Le moment magnétique retourne à sa valeur l'équilibre en suivant un mouvement de précession à la fréquence dite de Larmor, fonction de la valeur du champ statique. Le temps de relaxation longitudinal, temps caractéristique pour le retour de l’aimantation nucléaire à sa valeur d’équilibre thermodynamique, est ainsi du même ordre que cette fréquence de Larmor. Sa mesure informe sur les mouvements qui ont lieu à cette échelle de temps. Pour les champs les plus intenses utilisés (14 Teslas), les fréquences de Larmor sont de l’ordre de 600 MHz et ces mesures nous informent sur les mouvements ultra-rapides, tels que les vibrations moléculaires.
Si l'on souhaite caractériser des mouvements lents (de l'ordre de la seconde) par relaxométrie, le champ statique doit être bien inférieur, typiquement entre le champ terrestre et 1 Tesla. Cependant pour ces faibles valeurs de champ, la résolution spectrale est fortement dégradée, et l'on mesure ainsi une relaxation globale associée à l’ensemble des groupements chimiques des molécules étudiées. Cette mesure garde son intérêt, mais on pourrait souhaiter être plus précis dans le cas où seule une partie de la molécule effectue un mouvement lent, par exemple un petit ensemble d’acides aminés dans une protéine. Ainsi, pour obtenir les temps de relaxation lents pour chaque groupement chimique individualisé, il faut combiner des mesures de temps de relaxation à faible champ et des informations spectrales à fort champ.
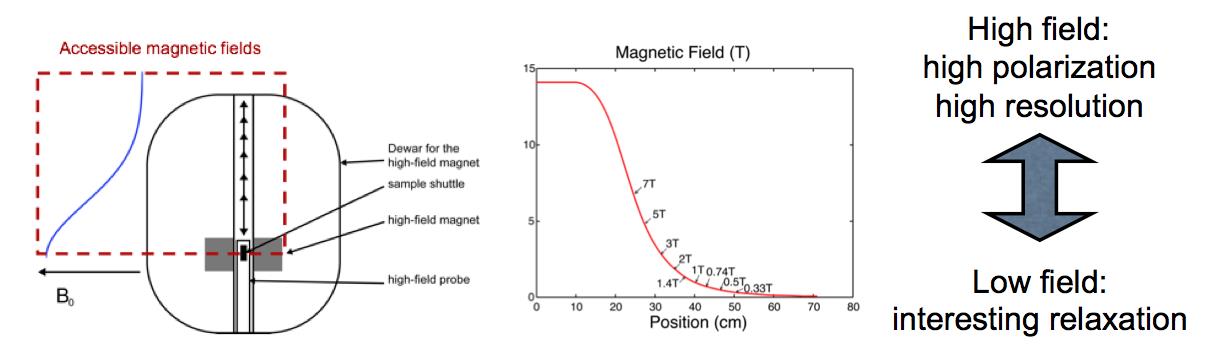
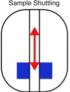
| Principe de la mesure de relaxométrie haute résolution par RMN : L'échantillon est plongé au centre de l'aimant supraconducteur dans un champ uniforme et très intense. L'échantillon fortement polarisé est ensuite rapidement déplacé le long de l’axe de l'aimant en position de champ de fuite permettant de mesurer des temps de relaxation lents. Enfin, l’échantillon est replacé en champ fort au centre de l’aimant, pour enregistrer son spectre RMN à haute résolution. |
Pour effectuer ces doubles mesures corrélées, à bas champ et haut champ, une collaboration de chercheurs de l'IRAMIS/NIMBE, de l’École Normale Supérieure de Paris, de l'EPFL/ISIC à Lausanne et de la Sté Brücker, propose un système de navette de translation rapide de l’échantillon, d'une zone de fort champ à une zone bas champ. L'échantillon est ainsi déplacé depuis la zone de champ polarisant homogène (14 T), au centre de l’aimant supraconducteur (permettant d'observer un spectre à haute résolution), à une position distante dans le champ de fuite (de l'ordre du champ magnétique terrestre) sur l’axe de l’aimant. La période de va-et-vient est typiquement de 100 ms, permettant la mesure indirecte du temps de relaxation pour plusieurs valeurs du champ traversé, tout en préservant l’information spectrale haute résolution, donnée par le déplacement chimique des fréquences de résonance.
La méthode proposée a été utilisée avec succès pour la mesure du temps de relaxation longitudinal pour les noyaux d’azote-15 de la protéine ubiquitine. Les mesures ainsi effectuées pour plusieurs valeurs du champ magnétique polarisant mettent en évidence des mouvements lents (associés à de longs temps de relaxation) sur certains résidus du squelette de la molécule de l’ubiquitine, ce qui permet une modélisation et une compréhension plus détaillées de sa dynamique moléculaire.
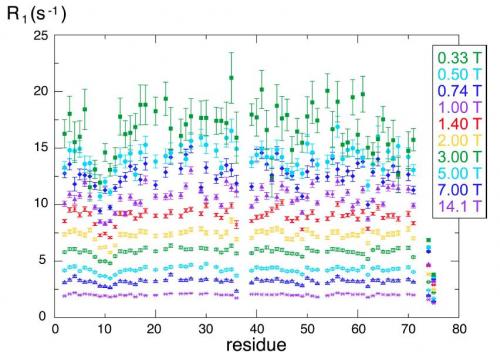
Mesures de la vitesse de relaxation (ou relaxivité R1= 1/T1) à différents champs magnétiques, pour différents résidus de l'ubiquitine. A fort champ, les valeurs mesurées sont indépendantes des résidus et de leur position sur le squelette de la molécule (points violets). A champ faible, des valeurs distinctes sont observées : les mouvements moléculaires sont plus importants pour certains résidus. En particulier les mouvements autours du résidu n°10 sont clairement mis en évidence (points verts) sur les mesures au champ le plus faible (0.33 T). Ces données permettent une modélisation fine de la dynamique de l’ubiquitine, seulement accessible par cette méthode.
Référence :
"Nanosecond timescale motions in proteins revealed by high-resolution NMR relaxometry"
C. Charlier, S. Khan, T. Marquardsen, P. Pelupessy, V. Reiss, D. Sakellariou, G. Bodenhausen, F. Engelke and F. Ferrage, J. Am. Chem. Soc., 135, 18665 (2013)
Le projet a été financé par l’ANR blanc SIMI 7 "DYNIDP".
Contact CEA : Dimitrios Sakellariou (IRAMIS/NIMBE/LSDRM).
Collaboration :
- Laboratoire des Biomolécules, Département de Chimie, UMR 7203 CNRS-UPMC-ENS, Ecole Normale Supérieure, 24 Rue Lhomond, 75231 Paris Cedex 05, France
Bruker BioSpin GmbH, Silberstreifen 4, D 76287 Rheinstetten, Germany
Laboratoire Structure et Dynamique par Résonance Magnétique, UMR 3299-SIS2M CEA/CNRS, IRAMIS, DSM, CEA Saclay, F-91191, Gif-sur-Yvette Cedex, France
>- Institut des Sciences et Ingénierie Chimiques, Ecole Polytechnique Fédérale de Lausanne, BCH, 1015 Lausanne, Switzerland.
• UMR 3685 NIMBE : Nanosciences et Innovation pour les Matériaux, la Biomédecine et l'Énergie
• Laboratoire Structure et Dynamique par Résonance Magnétique (LSDRM)